
【题目】已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
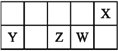
A. 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B. Z的最高价氧化物对应水化物的酸性比W的强
C. X的简单气态氢化物的稳定性比W的弱
D. X分别与Y、Z形成的化合物中化学键类型相同
【答案】A
【解析】由短周期主族元素X、Y、Z、W在元素周期表中的相对位置可知X处于第二周期,Y、Z、W处于第三周期,X与Y最外层电子数相差4,设Y的最外层电子数为a,则X最外层电子数为a+4,则Y最高正化合价为+a价,X的最低负化合价为(a+4)-8,又X的最低负价与Y的最高正价代数和为零,故a+(a+4)-8=0,解得a=2,故Y为Mg,则Z为Si、W为P、X为O。A、同周期主族元素从左到右原子半径减小,同主族元素自上而下原子半径增大,故原子半径:r(Y)>r(Z)>r(W)>r(X),A正确;B、非金属性W>Z,故Z的最高价氧化物对应水化物的酸性比W的弱,B错误;C、非金属性X>W,故X的简单气态氢化物的稳定性比W的强,C错误;D、X分别与Y、Z形成的化合物为MgO、SiO2,MgO属于离子化合物,含有离子键,而SiO2属于共价化合物,含有共价键,D错误。答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。己知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法正确的是
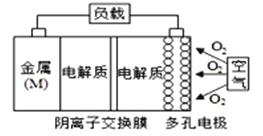
A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. M-空气电也放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
C. Al作电极材料时电解质溶液最好选酸性,这样更有利于反应的发生,同时防止负极区沉淀
D. 在Mg-空气电也中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
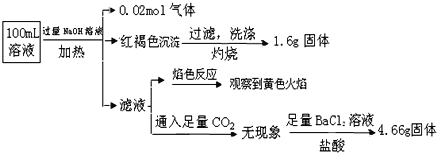
下列说法正确的是
A. 原溶液中c(Fe3+)=0.2mol/L
B. 溶液中至少有4种离子存在,其中Cl-一定存在
C. SO42-、NH4+、Na+一定存在,CO32-一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
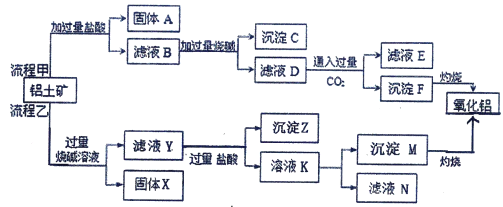
(1)流程甲中加入盐酸后生成Fe3+的离子方程式为________________;固体A是___________(填化学式),写出沉淀F转化为氧化铝的化学方程式是___________________________。
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________;固体X的主要用途有(写出1条即可) _____。沉淀Z为_______(填化学式)。由溶液K生成沉淀M的离子方程式是_________________________。
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol的镁、铝混合物溶于200mL4mol/LHCl溶液中,然后再滴加2mol/LNaOH溶液。
(1) 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=______mol,V2=______mL。
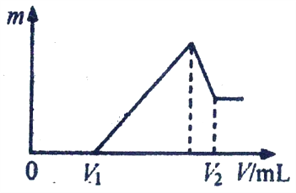
(2) 若在滴加NaOH 溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=______mL。
(3) 若混合物仍为0.2mol。其中Mg粉的物质的量分数为a,用200mL4mol/LHCl溶解此混合物后,再加入450mL2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 硫酸氢钠溶液与小苏打溶液的反应:H+ + HCO3- = CO2↑ + H2O
B. 用苛性钠溶液吸收过量SO2:SO2 +2OH-= SO32- + H2O
C. 二氧化锰和浓盐酸反应:MnO2+4HCl![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
D. 工业上氯气和石灰乳反应制漂白粉:Cl2 + 2OH-= ClO-+ Cl- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物能用相应元素的单质直接化合生成的是
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2 ⑦H2S ⑧FeCl3
A. ②③⑤⑦⑧ B. ①④⑥⑦ C. ①②③⑦⑧ D. ②③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入200 ml稀盐酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
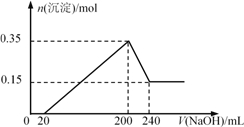
A. Mg和Al的总质量为9g
B. 盐酸的物质的量浓度为5 mol/L
C. NaOH溶液的物质的量浓度为5 mol/L
D. 生成的H2在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现溶液又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:该气体为CO2
猜想2:该气体为SO2
猜想3:_____________________
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则:
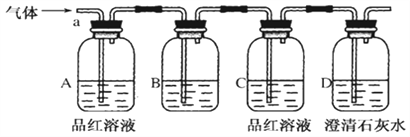
(1)B中应该装下列________试剂(填编号)。
A.NaCl溶液 | B.酸性KMnO4溶液 | C.盐酸 | D.澄清石灰水 |
A中品红溶液的作用是:_________________________________。
C中品红溶液的作用是:_________________________________。
(4)D中澄清石灰水的作用是:_______________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
【得出结论】
(5)由上述现象该小组同学确认该气体的成分为:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com