
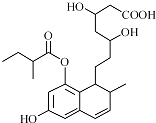
| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |


科目:高中化学 来源: 题型:
| A、2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ |
| B、2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),吸收热量571.6 kJ |
| C、2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ |
| D、2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率只能用一定时间内反应物浓度的减少来表示 |
| B、化学反应速率的大小主要取决于反应物的性质 |
| C、化学反应达到最大限度时,正逆反应速率也达到最大且相等 |
| D、用铁片和稀硫酸反应制取氢气时改用98%浓硫酸可以加快产生氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将 0.1 mol?L-1HCl溶液加热到100℃,溶液的pH仍为1 |
| B、将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低 |
| C、若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12 |
| D、在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
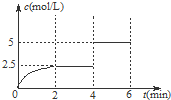 一定温度下有可逆反应:A(g)+2B(g)?2C(g)+D(g).现将4mol A和8mol B加入体积为2L的某密闭容器中,反应至4min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示.下列有关说法中正确的是( )
一定温度下有可逆反应:A(g)+2B(g)?2C(g)+D(g).现将4mol A和8mol B加入体积为2L的某密闭容器中,反应至4min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示.下列有关说法中正确的是( )| A、0~2 min内,正反应速率逐渐增大 |
| B、4 min时,A的转化率为50% |
| C、6 min时,B的体积分数为25% |
| D、4 min时,改变条件后,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8 L |
| B、1.4 L |
| C、3 L |
| D、4.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、2.3 |
| C、2.6 | D、2.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、pH=1的溶液中K+ CrO
| ||||||
B、饱和氯水中Cl- NO
| ||||||
C、能使pH试纸变红的溶液NH
| ||||||
D、FeCl2溶液中K+ Na+ SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com