
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
分析 (1)根据氢键分析解答;
(2)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(3)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(4)I3-离子的中心原子周围σ键电子对对数为2;离子晶体的晶格能与离子半径成反比,与离子所带电荷成正比;
(5)利用均摊法确定该立方体中含有的离子,根据ρV=$\frac{M}{{N}_{A}}$计算相对分子质量.
解答 解:(1)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(2)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:I;
(3)H5IO6(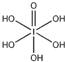 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有2个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有2个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO4,
故答案为:<;
(4)I3-离子的中心原子周围σ键电子对对数为2,离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,已知已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,所以发生的反应为CsICl2=CsCl+ICl,
故答案为:2;A;
(5)CaF2晶胞如图,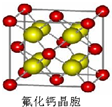 晶胞中Ca原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,F原子数目为8,CaF2的相对分子质量为M,晶胞质量m=$\frac{4M}{{N}_{A}}$,晶胞体积V=a3,根据ρV=$\frac{M}{{N}_{A}}$计算相对分子质量M=$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$,故答案为:$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$.
晶胞中Ca原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,F原子数目为8,CaF2的相对分子质量为M,晶胞质量m=$\frac{4M}{{N}_{A}}$,晶胞体积V=a3,根据ρV=$\frac{M}{{N}_{A}}$计算相对分子质量M=$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$,故答案为:$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$.
点评 本题考查物质结构与性质,题量较大,比较综合,涉及氢键、分子结构与性质、电离能、晶胞的计算等,侧重对主干知识的考查,需要学生熟练掌握基础知识,难度中等.


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
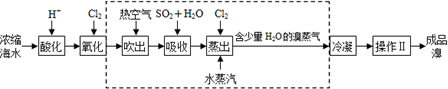
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
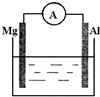 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
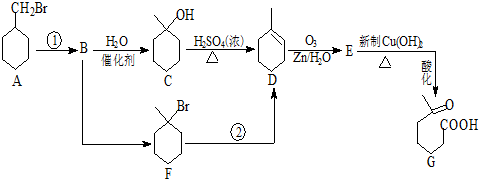
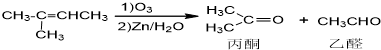
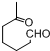 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$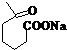 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.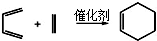
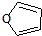 )也可以发生“Diels-Alder反应”,该化学方程式为:
)也可以发生“Diels-Alder反应”,该化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com