
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析 (1)①车排气管上装一个“催化转换器”,能使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的氧化,CO与NO反应产物无毒,所以生成二的气体是二氧化碳和氮气;
②由SO2可催化氧化为SO3,SO3在空气中能形成H2SO4,这也就是“催化转化器”的缺点;
③a、从新能源的来源和产物考虑;
b、从呼吸面具的作用和实用性考虑;
c、从植树造林的作用和原理考虑;
(2)①空气中存在CO2溶于水使雨水显酸性,正常雨水的pH值约等于5.6;
②由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的
H2SO4,2H2SO3+O2=2H2SO4,从而使雨水的酸性增强;
③根据酸雨的成分:H2SO3和H2SO4,根据H2SO3~Ba(OH)2,H2SO4~Ba(OH)2,可得n(SO2)=n(H2SO3)+n(H2SO4)=n[Ba(OH)2],求出SO2的体积;根据极限法求出当白色沉淀全部为BaSO3以及白色沉淀全部为BaSO4时的质量,最终求出白色沉淀的范围.
解答 解:(1)①可知催化转化器的作用是让CO与NO反应,生成无毒气体,治理的目的是除去污染气体生成无毒的气体,依据元素守恒可得产物为CO2和N2,故化学方程式为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
②由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度,
故答案为:SO2转化为SO3,产生了硫酸酸雾;
③a.开发新能源,如太阳能、风能、潮汐能等对环境是无污染的,减少化石燃料得使用,故a正确;
b.戴呼吸面具,呼吸面具是在空气中有极度危险的病菌或污染物是佩戴的,平时的生活中是不宜戴的,故b错误;
c.植树造林可以净化空气,保护环境,但不能从源头上控制污染,故c错误;
故答案为:a;
(2)①空气中存在CO2溶于水生成碳酸使雨水显酸性,正常雨水的pH值约等于5.6;
故答案为:大气中的CO2溶于雨水;
②雨水的pH值变小的原因是由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,.2H2SO3+O2=2H2SO4,从而使雨水的酸性增强.
故答案为:H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,PH减小;
③a.因酸雨的成分为H2SO3和H2SO4,根据H2SO3~Ba(OH)2,H2SO4~Ba(OH)2,可得n(SO2)=n(H2SO3)+n(H2SO4)=n[Ba(OH)2]=0.5mol•L-1×60.00mL×10-3L•mL-1=0.0300mol,所以V(SO2)=0.0300mol×22.4L•mol-1=0.672L,
故答案为:0.672L;
b.设生成沉淀物的质量为w,
若白色沉淀全部为BaSO3,沉淀质量为0.0300mol×217g•mol-1=6.51g,
若白色沉淀全部为BaSO4,沉淀质量为0.0300mol×233g•mol-1=6.99g,
所以,6.51g<w≤6.99g,
故答案为:6.51g<w≤6.99g.
点评 本题考查较为综合,涉及多方面知识,为高考常见题型,侧重于学生的分析能力、实验能力的考查,题目涉及根据化学方程式进行计算,同时根据极限法判定产物的质量,也考查了学生分析问题和解决问题的能力,同时寓问题解决的过程中渗透了关心和爱护环境的思想教育.


科目:高中化学 来源: 题型:实验题
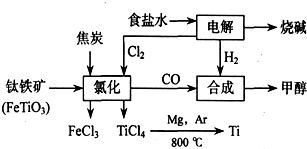
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 强氧化剂与强还原剂不一定能发生氧化还原反应 | |
| D. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ③④⑤ | C. | ①③⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
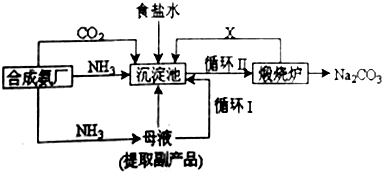
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6 种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
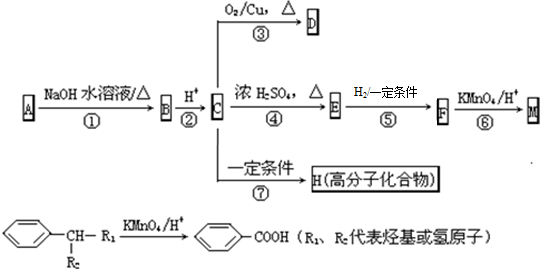
 .
.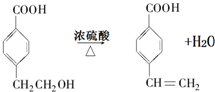 反应⑦的化学方程式为
反应⑦的化学方程式为 .
.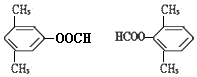 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
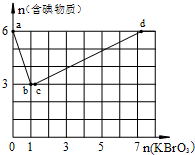 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com