
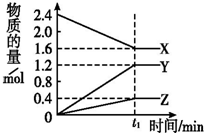
 ij�¶��£���2L�ܱ�������3����̬���ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ�⣬��ͼ��ʾ��
ij�¶��£���2L�ܱ�������3����̬���ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ�⣬��ͼ��ʾ��| 2 |
| 3 |
| 0.8mol |
| 2.4mol |
| 1 |
| 3 |
| 1 |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ӧ�������������� |
| B���μӷ�Ӧ��HCl��0.4mol |
| C�������ڷ�Ӧ�й�ʧȥ0.4mol���� |
| D����þ��0.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K2CO3��HCl��CaCl2 |
| B��Na2CO3��HNO3��MgSO4 |
| C��Na2CO3��HCl��Ba��NO3��2 |
| D��H2SO4��Na2CO3��AgNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��������Һ��ͨ������������̼��2C6H5O-+CO2+H2O��2C6H5OH+CO
| ||
| B��������ͭ��Һ��ȥ��Ȳ�е��������壺Cu2++S2-=CuS�� | ||
C��������̼�����Һ��Ӧ��2CH3COOH+CO
| ||
| D�����Ը��������Һ��ͨ����Ȳ����ɫ��ȥ��2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
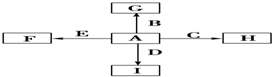
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����β���dz�����Ҫ������Ⱦ��о���������β����Ϊ������������Ҫ����
����β���dz�����Ҫ������Ⱦ��о���������β����Ϊ������������Ҫ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
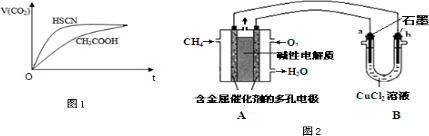
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
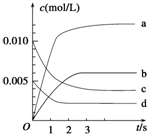 ��2L�ܱ������ڣ�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����H��0��ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������ڣ�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����H��0��ϵ�У�n��NO����ʱ��ı仯�����| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʹʯ����ֽ��������Һ�У�NH4+��Na+��SO42-��Cl-�ܴ������� |
| B�����д���AlO2-����Һ�У�Na+��Ba2+��Cl-��HCO3- �ܴ������� |
| C������������Һ�У�Cu2+��Fe3+��NO3-��Cl-���ܴ������� |
| D��c��H+��=0.1mol?L-1����Һ�У�Na+��Mg2+��SO42-��ClO-���ܴ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com