
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应,在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00 mol·L-1,c(N2)=3.00 mol·L-1,c(NH3)=4.00 mol·L-1,此温度下该反应的平衡常数K=________。
(2)在三个相同容器中各充入1 mol N2和3 mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是________(填字母)。

A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:C(s)+H2O(g)=H2(g)+CO(g)
ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·K-1 ·mol-1
该反应在常温下能否自发进行?________(填“能”或“不能”)。
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
A.白色沉淀为ZnS,黑色沉淀为CuS
B.上述现象说明ZnS的Ksp小于CuS的Ksp
C.利用该原理可实现一种沉淀转化为更难溶的沉淀
D.该过程破坏了ZnS的溶解平衡
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
A.氯气 B.二氧化硫 C.醋酸钠 D.氯化钾
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
一定温度下, 在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
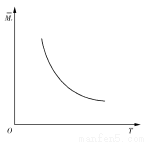
A.温度升高,平衡常数K减小
B.化学计量数a为1
C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2
D.X的转化率α=Q1/Q
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
某恒温容器用固定隔板隔成甲、乙两容器,如图所示,在甲、乙两容器中都充入1 mol A和2 mol B,反应3A(g)+B(g) xC(g)达到平衡后,甲、乙两容器中A物质的浓度比为5:3,甲、乙两容器中C的体积分数大小为 ( )
xC(g)达到平衡后,甲、乙两容器中A物质的浓度比为5:3,甲、乙两容器中C的体积分数大小为 ( )

A.甲>乙 B.甲<乙 C.甲=乙 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g) 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是 ( )
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是 ( )
A.4 s内,v(B)=0.075 mol/(L·s)
B.当c(A)∶c(B)∶c(C)=2∶1∶2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:填空题
某课外活动小组设计了如图所示的装置,调节滑动变阻器控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了很令人高兴的现象。(阳离子交换膜只允许阳离子和水通过)

请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:________;阳极:________。
(2)观察到A装置中的现象是:①________;②________;③________。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b。再观察C装置,若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):____________________________________。
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见:
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g);ΔH=-Q1kJ/mol;CO(g)+1/2 O2(g)=CO2(g);ΔH=-Q2 kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是 ( )
A.1/3Q1 kJ B.1/3Q2 kJ C.1/3(Q1+Q2) kJ D.1/2Q2 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com