
| A. | 纯盐酸、空气、硫酸、干冰 | B. | 蒸馏水、氨水、碳酸氢钠、二氧化硫 | ||
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 生石灰、浓硫酸、氯化铜、碳酸钠 |
分析 根据纯净物是一种物质组成的物质;
混合物是不同物质组成的物质;
电解质是水溶液中或熔融状态下都导电的化合物;
非电解质是水溶液中和熔融状态下都不导电的化合物.
解答 解:A、纯盐酸是混合物.硫酸是混合物,既不是电解质也不是非电解质,故A错误;
B、蒸馏水是纯净物,氨水是混合物,碳酸氢钠属于电解质,二氧化硫不能电离,属于非电解质,故B正确;
C、铁是金属单质,既不是电解质也不是非电解质,碳酸钙属于盐,是电解质,故C错误;
D、生石灰是混合物,碳酸钠是盐,属于电解质,故D错误,
故选B.
点评 本题考查纯净物、混合物、电解质和非电解质的概念,需要对相关概念有深刻的理解,并能对相关属类的物质有清晰的理解,这要求在学习概念时,既要理解概念,又要能举出典型例子.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
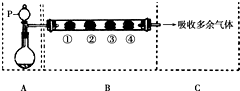 用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:
用如图装置可以完成一系列实验(图中夹持装置已略去).请回答下列问题:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘 水混合液 | 氢硫酸 |
| 现象 | a | b | 褪色 | 浅黄色 |
| 体现SO2的性质 | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
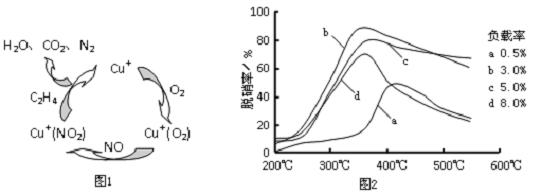
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
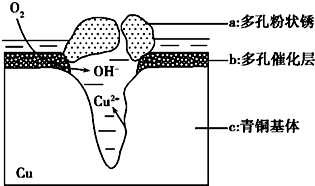 如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图1为青铜器在潮湿环境中发生的电化学腐蚀的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
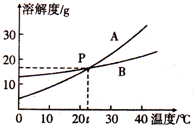 根据图中A、B两种固体物质的溶解度曲线,回答下列问题:
根据图中A、B两种固体物质的溶解度曲线,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com