
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
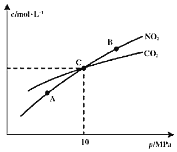
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
【答案】N2![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)N2H4易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为:N2H4·H2O![]() N2H5++OH-;
N2H5++OH-;
(2)①平衡常数只受温度影响,所以Kc(A)=Kc(B);
②增大压强平衡向气体体积减小的方向移动,该反应的正反应是气体体积增大的反应,所以A、B、C三点中NO2的转化率最高的是A点;
③在C点时,CO2与NO2的浓度相等,根据反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),可知N2的浓度为CO2的一半,所以混合气体中CO2的体积分数为
N2(g)+2CO2(g),可知N2的浓度为CO2的一半,所以混合气体中CO2的体积分数为![]() ,NO2的体积分数
,NO2的体积分数![]() ,N2的体积分数
,N2的体积分数![]() ,所以反应的压强平衡常数KP=
,所以反应的压强平衡常数KP=![]() =
= MPa=2MPa;
MPa=2MPa;
(3)由HNO2的电离平衡常数Ka=5.1×10-4,H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11,可知溶液中完全反应生成等物质的量的Na2CO3、NaHCO3和NaNO2,可判断水解程度大小顺序为CO32->HCO3->NO2-,CO32-水解生成HCO3-,所以溶液中CO32-、HCO3-和NO2-的浓度大小关系为:c(HCO3-)> c(NO2-)> c(CO32-);
(4)CH3NH2+H2O![]() CH3NH3++OH-的Kb=
CH3NH3++OH-的Kb=![]() ,向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,Kb=c(OH-)=10-3.4mol/L,c(H+
,向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,Kb=c(OH-)=10-3.4mol/L,c(H+![]() =10-10.6mol/L,pH=10.6;
=10-10.6mol/L,pH=10.6;
(5)由盖斯定律可知将②-①可得△H=-189.2kJ·mol-1-(+210.5kJ·mol-1)=-399.7kJ·mol-1,则CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-399.7kJ·mol-1。
CaS(s)+3CO2(g) △H=-399.7kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化:
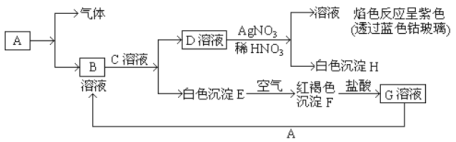
请回答下列问题:
(1)写出B的化学式___________,D的化学式为____________;
(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
(4)除去溶液B中混有的少量G溶液的最适宜方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:
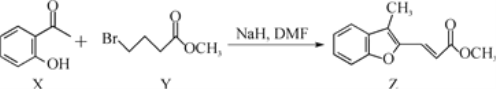
下列说法错误的是( )
A.物质X中所有原子可能在同一平面内
B.物质X在空气中易被氧化
C.等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶2
D.等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为4:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关判断正确的是![]()
A.NaOH溶液与![]() 溶液混合至中性后:
溶液混合至中性后:![]()
B.![]() 的
的![]() 溶液与
溶液与![]() 的KOH溶液等体积混合后:
的KOH溶液等体积混合后:![]()
C.![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液等体积混合后:
溶液等体积混合后:![]()
D.pH相等的![]()
![]()
![]() 溶液,
溶液,![]() 大小顺序:
大小顺序:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________;
(2)V至少为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
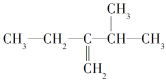
【题目】Ⅰ.写出下列有机物的系统命名或结构简式:
(1)![]() ____________。
____________。
(2)CH3CH(CH3)C(CH3)2CH2CH3____________。
(3)  ________。
________。
Ⅱ.食品安全关系着国民生计,影响食品安全的因素很多。
(1)聚偏二氯乙烯(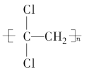 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH=CH—CH2—CH=CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:_______。
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实脸(夹持装置略去):
I.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为_________。
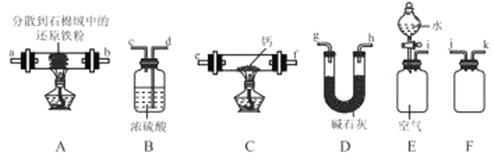
(2)按气流由左到右的方向,上述装置合理的连接顺字为__________(填仪器接口字母)。
(3)按连接好的装置进行实验。
①实验步骤如下,检查装置气密性,加入药品:_______(请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为_________。
③装置C的硬质玻璃管中的现象为_________。
(4)设计实验证明Ca3N2中混有钙单质:_______________。
II.测定氮化钙纯度。
i.称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1 .00mol/L盐酸中,充分反应后,将所得溶液稀释到200 . 00 mL;
ii.取20 . 00mL稀释后的溶液,用0 . 2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25 . 00 mL。
(5)所取固体中氮化钙的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:
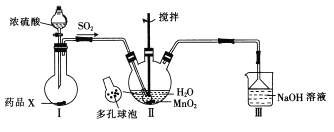
下列说法错误的是
A. 装置I烧瓶中放入的药品X为铜屑
B. 装置II中用“多孔球泡”可增大SO2的吸收速率
C. 装置III用于吸收未反应的SO2
D. 用装置II反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com