
| A. | 干冰制冷 | B. | 高炉炼铁 | C. | 醋酸除垢 | D. | 纯碱去油 |
科目:高中化学 来源: 题型:解答题
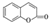 )是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下:
)是一种应用广泛的香料和药物中间体.以甲苯为原料生产香豆素流程如下: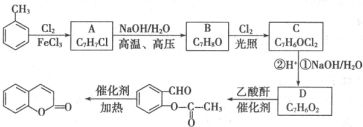
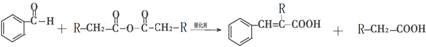
 ,D的结构简式是
,D的结构简式是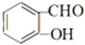 .
.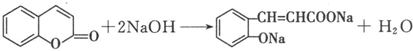 .
. .
.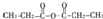 ,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是
,通过反应Ⅰ和反应Ⅱ,得到芳香化合物E,E的结构简式是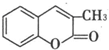 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的反应热为△H=-571.6kJ/mol,是放热反应 | |
| B. | 该反应的△H与各物质的状态有关,与化学计量数也有关 | |
| C. | 该式的含义为:25℃、101kPa下,2mol氢气完全燃烧生成液态水时放出热量571.6kJ | |
| D. | 该反应为氢气燃烧的热化学方程式,由此可知氢气的燃烧热为571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的摩尔质量是 35.5g/mol | B. | 98g H2SO4中含氧原子个数为NA | ||
| C. | 含NA个氢原子的H2O的质量是18 g | D. | 22.4 L 氦气的质量是 4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 调节体温 | B. | 帮助消化 | C. | 排泄废物 | D. | 提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电解过程中溶液pH不会变化 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com