
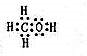 .
.分析 A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,而且D的原子序数大于O,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,据此结合元素化合物的性质解答.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,而且D的原子序数大于O,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(2)由A、B、W三种元素组成的18电子微粒:即H、C、O,三者电子数分别为1、6、8,加起来为15,只能再加三个氢原子,即18电子微粒应该为CH4O,是甲醇,电子式为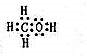 ,
,
故答案为: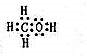 ;
;
(3)A2W2为H2O2,是二元弱酸,以第一步电离为主,则电离方程式为H2O2?HO2-+H+,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:H2O2?HO2-+H+;BaO2+H2SO4=BaSO4↓+H2O2;
(4)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(5)NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56L;
(6)钠的某化合物呈淡黄色,该化合物为过氧化钠,由于Na2O2和Fe2+的物质的量之比为1:2,反应没有气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+.
点评 本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度,题目难度中等.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+ Mg2+ Cl- NO3- | B. | Na+ Fe3+ Al3+ OH- | ||
| C. | K+ NH4+ | D. | Na+ K+ CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,AB2所含化学键的类型:离子键、非极性共价键(极性共价键、非极性共价键、离子键).
,AB2所含化学键的类型:离子键、非极性共价键(极性共价键、非极性共价键、离子键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2燃烧热△H为-285.8kJ/mol,则:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | 已知稀盐酸与NaOH稀溶液反应的中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol | |
| C. | 电解稀硫酸可能发生反应:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| D. | 以石墨为电极电解MgCl2溶液的总离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜为阳极、铜为阴极,电解液为CuSO4溶液 | |
| B. | 石墨为阳极、铁为阴极,电解液为CuSO4溶液 | |
| C. | 铁为阳极,铜为阴极,电解液为AgNO3溶液 | |
| D. | 石墨为阳极,铁为阴极,电解液为NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com