
”¾ĢāÄæ”æĻÖÓŠA”¢B”¢C”¢D”¢E”¢F”¢GŹĒŌŖĖŲÖÜĘŚ±ķÖŠĒ°18ŗÅŌŖĖŲ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£AÓėEĶ¬Ö÷×åĒŅAµÄŌ×Ó°ė¾¶×īŠ”£»BÓėD×é³É³£¼ū»ÆŗĻĪļBD”¢BD2£¬ĒŅ¶žÕßĻą¶Ō·Ö×ÓÖŹĮæĻą²ī16£» FµÄ×īĶā²ćµē×ÓŹżµČÓŚµē×Ó²ćŹż£¬Gµ„ÖŹŹĒ»ĘĀĢÉ«ĘųĢ唣
£Ø1£©BŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ__________”£
£Ø2£©C2µÄµē×ÓŹ½ĪŖ______£¬D”¢E”¢G¶ŌÓ¦µÄ¼ņµ„Ąė×Ó°ė¾¶ÓÉŠ”µ½“óµÄĖ³ŠņĪŖ_______£ØÓĆĄė×Ó·ūŗűķŹ¾£©”£
£Ø3£©Š“³öŅ»øöÄÜÓĆÓŚÖ¤Ć÷ŌŖĖŲB”¢GµÄ·Ē½šŹōŠŌĒæČõµÄ»Æѧ·“Ó¦·½³ĢŹ½____________”£
£Ø4£©»ÆŗĻĪļ¼×ÓÉD”¢FĮ½ŌŖĖŲ×é³É£¬½«»ÆŗĻĪļ¼×”¢Cµ„ÖŹÓėBµ„ÖŹ°“ĪļÖŹµÄĮæÖ®±Č1”Ć1”Ć3ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æɵƵ½ŅŅŗĶBD£¬Š“³ö·“Ó¦·½³ĢŹ½ĪŖ________”£
”¾“š°ø”æµŚ¶žÖÜĘŚµŚIVA×å![]() r(Cl-)>r(O2-)>r£ØNa+£©2HClO4+Na2CO3=CO2+H2O+2NaClO4Al2O3+N2+3C=2AlN+3CO
r(Cl-)>r(O2-)>r£ØNa+£©2HClO4+Na2CO3=CO2+H2O+2NaClO4Al2O3+N2+3C=2AlN+3CO
”¾½āĪö”æ
ĻÖÓŠA”¢B”¢C”¢D”¢E”¢F”¢GŹĒŌŖĖŲÖÜĘŚ±ķÖŠĒ°18ŗÅŌŖĖŲ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£AÓėEĶ¬Ö÷×åĒŅAµÄŌ×Ó°ė¾¶×īŠ”£¬ŌŚĒ°18ŗÅŌŖĖŲÖŠ£¬Ō×Ó°ė¾¶×īŠ”µÄĪŖH£¬BÓėD×é³É³£¼ū»ÆŗĻĪļBD”¢BD2£¬ĒŅ¶žÕßĻą¶Ō·Ö×ÓÖŹĮæĻą²ī16£¬ĖłŅŌDµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ16£¬ĖłŅŌDĪŖOŌŖĖŲ£¬FµÄ×īĶā²ćµē×ÓŹżµČÓŚµē×Ó²ćŹż£¬ĒŅŌ×ÓŠņŹż“óÓŚ16£¬ĖłŅŌFĪŖAlŌŖĖŲ£¬Gµ„ÖŹŹĒ»ĘĀĢÉ«ĘųĢ壬ŌņGĪŖClŌŖĖŲ£¬AÓėEĶ¬Ö÷×壬ŌņEĪŖNaŌŖĖŲ£¬BĪŖCŌŖĖŲ£¬CĪŖNŌŖĖŲ”£
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬BĪŖCŌŖĖŲ£¬ŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖƵŚ¶žÖÜĘŚµŚIVA×壻
£Ø2£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬CĪŖNŌŖĖŲ£¬N2µÄµē×ÓŹ½ĪŖ![]() £»Ąė×Ó°ė¾¶±Č½Ļµē×Ó²ćŹżŌ½¶ą£¬°ė¾¶Ō½“ó£¬Ņņ“Ėr(Cl-)>r(O2-)£¬ r(Cl-)>£ØNa+£©£¬µē×Ó²ćŹżĻąĶ¬£¬ŗĖµēŗÉŹżŌ½“ó°ė¾¶Ō½Š”£¬Ņņ“Ėr(O2-)>r£ØNa+£©£¬ĖłŅŌČżÕߥė×Ó°ė¾¶“óŠ”ĪŖr(Cl-)>r(O2-)>r£ØNa+£©£»
£»Ąė×Ó°ė¾¶±Č½Ļµē×Ó²ćŹżŌ½¶ą£¬°ė¾¶Ō½“ó£¬Ņņ“Ėr(Cl-)>r(O2-)£¬ r(Cl-)>£ØNa+£©£¬µē×Ó²ćŹżĻąĶ¬£¬ŗĖµēŗÉŹżŌ½“ó°ė¾¶Ō½Š”£¬Ņņ“Ėr(O2-)>r£ØNa+£©£¬ĖłŅŌČżÕߥė×Ó°ė¾¶“óŠ”ĪŖr(Cl-)>r(O2-)>r£ØNa+£©£»
£Ø3£©ŌŖĖŲ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌŌ½Ē棬ŌņĘä·Ē½šŹōŠŌŌ½Ē棬¶ųøł¾Ż»Æѧ·“Ó¦¹ęĀÉ£¬ĒæĖįæÉŅŌÖʱøČõĖį£¬ĖłŅŌ2HClO4+Na2CO3=CO2+H2O+2NaClO4æÉŅŌÖ¤Ć÷ClµÄ·Ē½šŹōŠŌĒæÓŚC£»
£Ø4£©»ÆŗĻĪļ¼×ÓÉD”¢FĮ½ŌŖĖŲ×é³É£¬ĖłŅŌ»ÆŗĻĪļ¼×ĪŖŃõ»ÆĀĮ£¬ Cµ„ÖŹĪŖµŖĘų£¬ Bµ„ÖŹĪŖĢ¼£¬ČżÕß°“ĪļÖŹµÄĮæÖ®±Č1”Ć1”Ć3ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æɵƵ½ŅŅŗĶŅ»Ńõ»ÆĢ¼£¬øł¾ŻÖŹĮæŹŲŗćæÉÖŖŅŅĪŖµŖ»ÆĀĮ£¬·“Ó¦·½³ĢŹ½ĪŖAl2O3+N2+3C=2AlN+3CO”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗ ¢ŁCO(g)£«1/2O2(g)===CO2(g)””¦¤H£½£283.0 kJ”¤mol£1 ¢ŚH2(g)£«1/2O2(g)===H2O(g)””¦¤H£½£241.8 kJ”¤mol£1ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A. ³£ĪĀ³£Ń¹Ź±£¬Č¼ÉÕ1molĒāĘų·ÅČČĪŖ241.8 kJ
B. ÓÉ¢ŁæÉÖŖ£¬1 mol CO(g)ŗĶ1/2mol O2(g)·“Ӧɜ³É 1 mol CO2(g)£¬·Å³ö283.0 kJµÄČČĮæ
C. æÉÓĆĻĀĶ¼±ķŹ¾CO2(g)”śCO(g)£«![]() O2(g)·“Ó¦ŹĒĪüČČ·“Ó¦
O2(g)·“Ó¦ŹĒĪüČČ·“Ó¦

D. Éś³É1 mol H2O(g)£¬Ęä·“Ó¦ČČĪŖ£241.8 kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢśŹĒÄæĒ°ŹĄ½ēÉĻÓĆĮæ×ī“óµÄ½šŹō²ÄĮĻ£¬ÓŠ¹ŲĢś¼°Ęä»ÆŗĻĪļµÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A.“ÅĢśæóµÄÖ÷ŅŖ³É·ÖŹĒFe3O4B.Fe3£«ÓöKSCNČÜŅŗĻŌŗģÉ«
C.Feæɱ»ĄäµÄÅØHNO3¶Ū»ÆD.Fe2£«”¢Fe3+ÓėNaOHČÜŅŗ·“Ó¦ĻÖĻóĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪŽÉ«ĶøĆ÷ČÜŅŗÖŠ£¬ÄÜ“óĮæ¹²“ęµÄĄė×Ó×éŹĒ£Ø””””£©
A.Cu2+”¢Na+”¢SO42-”¢Cl©B.Ba2+”¢Na+”¢OH©”¢SO42-
C.OH©”¢HCO3©”¢Ca2+”¢Na+D.K+”¢Na+”¢OH©”¢NO3©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷Ź¾ŅāĶ¼Óė¶ŌÓ¦µÄ±ķŹöÕżČ·µÄŹĒ( )
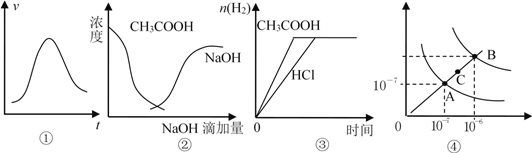
A. Ķ¼¢Ł±ķŹ¾Ņ»¶ØĢõ¼žĻĀij»Æѧ·“Ó¦µÄĖŁĀŹĖꏱ¼ä±ä»ÆµÄĒ÷ŹĘĶ¼£¬øĆ·“Ó¦Ņ»¶ØĪŖ·ÅČČ·“Ó¦
B. Ķ¼¢ŚÖŠĒśĻß±ķŹ¾½«ĒāŃõ»ÆÄĘČÜŅŗµĪ¼Óµ½“×ĖįČÜŅŗÅØ¶ČµÄ±ä»ÆĒ÷ŹĘĶ¼
C. Ķ¼¢Ū±ķŹ¾µČĢå»ż”¢µČĪļÖŹµÄĮæÅØ¶ČµÄŃĪĖįŗĶ“×ĖįČÜŅŗ£¬·Ö±š¼ÓČė×ćĮæĆ¾·Ū£¬²śÉśH2µÄĪļÖŹµÄĮæµÄ±ä»Æ
D. Ķ¼¢ÜĪŖĖ®µÄµēĄėĘ½ŗāĒśĻßĶ¼£¬Čō“ÓAµćµ½Cµć£¬æɲÉÓĆŌŚĖ®ÖŠ¼ÓČėŹŹĮæNaOH¹ĢĢåµÄ·½·Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠ”×éĪŖĮĖĢ½¾æŅ»ÖÖ²»ČÜŠŌŃĪX£Ø½öŗ¬ĖÄÖÖŌŖĖŲ£©µÄ×é³ÉŗĶŠŌÖŹ£¬Éč¼Ę²¢Ķź³ÉĮĖČēĻĀŹµŃé£ŗ

Ēė»Ų“š£ŗ
£Ø1£©X³żĮĖŗ¬ÓŠH”¢OŌŖĖŲĶā£¬»¹ÓŠ___ŌŖĖŲ£ØĢīŌŖĖŲ·ūŗÅ£©”£
£Ø2£©»ģŗĻĘųĢåĶØČėäåĖ®ÖŠ·¢Éś·“Ó¦¢ŪµÄĄė×Ó·½³ĢŹ½________”£
£Ø3£©Š“³öXµÄ»ÆѧŹ½_________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
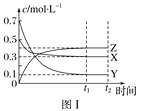
”¾ĢāÄæ”æijĪĀ¶ČŹ±£¬ŌŚĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåÅØ¶ČµÄ±ä»ÆČēĶ¼¢ńĖłŹ¾£¬ČōĘäĖūĢõ¼ž²»±ä£¬µ±ĪĀ¶Č·Ö±šĪŖT1ŗĶT2Ź±£¬YµÄĢå»ż·ÖŹżÓėŹ±¼ä¹ŲĻµČēĶ¼¢ņĖłŹ¾”£ŌņĻĀĮŠ½įĀŪÕżČ·µÄŹĒ(””””)
 ””
””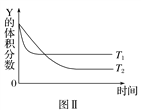
A. øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖX(g)£«3Y(g) ![]() 2Z(g)””¦¤H>0
2Z(g)””¦¤H>0
B. ČōĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Õż”¢Äę·“Ó¦ĖŁĀŹ¾łŌö“ó£¬XµÄ×Ŗ»ÆĀŹŌö“ó
C. ĪĀ¶Č·Ö±šĪŖT1ŗĶT2Ź±µÄĘ½ŗā³£Źż“󊔹ŲĻµĪŖK2>K1
D. “ļµ½Ę½ŗāŗó£¬ČōĘäĖūĢõ¼ž²»±ä£¬ĶØČėĻ”ÓŠĘųĢå£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷ÖŠÕżČ·µÄŹĒ £Ø £©
A.Õō·¢²Ł×÷Ź±£¬Ó¦Ź¹»ģŗĻĪļÖŠµÄĖ®·ÖĶźČ«ÕōøÉŗ󣬲ÅÄÜĶ£Ö¹¼ÓČČ
B.ÕōĮó²Ł×÷Ź±£¬Ó¦Ź¹ĪĀ¶Č¼ĘĖ®ŅųĒņææ½üÕōĮóÉÕĘæµÄÖ§¹ÜæŚ“¦
C.ÓĆ¾Ę¾«ŻĶČ”äåĖ®ÖŠµÄäåµ„ÖŹµÄ²Ł×÷æÉŃ”ÓĆ·ÖŅŗĀ©¶·¶ųŗó¾²ÖĆ·ÖŅŗ
D.ŻĶČ”²Ł×÷Ź±£¬Ó¦Ń”ŌńÓŠ»śŻĶČ”¼Į£¬ĒŅŻĶČ”¼ĮµÄĆܶȱŲŠė±ČĖ®“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚĒæČõµē½āÖŹ¼°·Ēµē½āÖŹµÄÅŠ¶ĻĶźČ«ÕżČ·µÄŹĒ
Ń”Ļī | A | B | C | D |
Ēæµē½āÖŹ | NaCl | CaCl2 | HNO3 | H2SO4 |
Čõµē½āÖŹ | CH3COOH | BaSO4 | AlCl3 | HF |
·Ēµē½āÖŹ | Cl2 | CO2 | SO2 | C2H5OH |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com