
(15分)【化学——选修2:化学与技术】
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。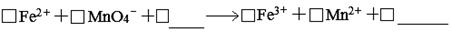
(2)滴定达到终点的标志是 。
(3)产品中FeSO4·7H2O的质量分数为 。
(除标注外,每空2分,共15分)
(一) (1) 4FeS2 + 11O2  2Fe2O3 + 8SO2 (2) B C D(少对一个扣1分,有错计0分) (3) 冷凝管 (4)B D(对一个计1分,有错计0分)
2Fe2O3 + 8SO2 (2) B C D(少对一个扣1分,有错计0分) (3) 冷凝管 (4)B D(对一个计1分,有错计0分)
(二)(1) 5 1 8H+ 5 1 4H2O (有错计0分 )
(2) 滴加最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,且半分钟不恢复原来颜色(合理答案均计分)
(3) 93.56% 或93.6%(3分)
解析试题分析:(一)(1)黄铁矿的主要成分是FeS2 ,与氧气反应生成二氧化硫、氧化铁,化学方程式为4FeS2 + 11O2  2Fe2O3 + 8SO2 ;
2Fe2O3 + 8SO2 ;
(2)A、都表示正反应速率,错误;B、各组分的体积分数不再变化,说明反应已达平衡状态,正确;C、该反应的热效应不为0,所以无论是吸热还是放热反应,未达 平衡时温度都在变化,当温度不再变化时,说明已达平衡状态,正确;D、该反应是气体的物质的量发生改变的可逆反应,所以气体的相对分子质量一直变化,当达到平衡时气体的平均相对分子质量不再变化,正确;E、体积不变的容器中,根据质量守恒定律,气体的密度一直不变,不能判断平衡是否到达,错误,答案选BCD;
(3)化学实验室中常用作热交换的仪器是冷凝管;
(4)A、SO2,微量的SO3、酸雾都与氢氧化钠溶液反应,所以无法测定二氧化硫的含量,错误;B、二氧化硫与酸性高锰酸钾溶液反应,其余物质不反应,可以测定二氧化硫的含量,正确;C、氨水溶液显碱性,与A的道理相同,不能测定二氧化硫的含量,错误;D、二氧化硫与碘反应,蓝色溶液变为无色,其余物质不与碘反应,可以测定二氧化硫的含量,正确,答案选BD;
(二)(1)酸性高锰酸钾溶液的氧化性更强,所以反应物的空白处应是H+,则产物的空白处应是H2O,根据得失电子守恒规律,Mn元素化合价降低5价,Fe元素化合价升高1价,所以Fe元素的系数是5,Mn元素的系数是1,再根据电荷守恒、观察法配平其余物质的系数,答案是5 1 8H+ 5 1 4H2O;
(2)用酸性高锰酸钾溶液滴定亚铁离子,高锰酸钾溶液为紫色,滴定达到终点时,滴加最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,且半分钟不恢复原来颜色;
(3)消耗高锰酸钾的物质的量为0.035L×0.01mol/L,则原溶液中Fe2+的物质的量为0.035L×0.01mol/L×5×10=0.0175mol,所以FeSO4·7H2O的质量是0.0175mol×278g/mol=4.865g,则产品中FeSO4·7H2O的质量分数为4.865g/5.2g×100%=93.56%.
考点:考查硫酸工业,反应原理,化学平衡状态标志的判断,氧化还原反应的计算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
已知硫铁矿在沸腾炉中煅烧,通入沸腾炉中的气体原料是空气,其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是
| A.0.13 | B.0.15 | C.0.22 | D.0.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是 。
(2)上述流程中,工业上分离H2 、CO2合理的方法是 。
A混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B混合气加压冷却,使CO2液化
C混合气用氨水洗涤
D混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行 ,目的是____________________;在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法 。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,阐述图中的两处可以合理利用资源情况 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作①、②分别为__________、__________。
(2)写出生成“产品”的离子方程式_________________________________。
(3)检验合成氨厂废气中含有氨气的方法是___________________________
___________________________________________________________。
(4)副产品的化学式为__________,该联合生产工艺中可循环使用的物质是
________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着世界粮食需求量的增加,农业对化学肥料的需求越来越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下:
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在________中进行合成氨。则沿X方向回去的物质是________。
(2)目前生产尿素是以氨气与CO2为原料,发生反应的化学方程式是________、________。
尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是________。
(3)沉淀池中发生反应的化学方程式是________________。
(4)上述生产中的副产品氯化铵长期使用会造成土壤酸化、变硬甚至板结。对土壤的酸碱性进行测定与改良是保护________、提高土壤肥力的有效途径。测定土壤的pH的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于________周期__________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是___________________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为__________________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是______________________________________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由美国通用原子能公司(GA)提出的碘硫循环被公认为是效率最高(预期转化率可达50%以上)、最有希望实现的热化学分解物质X的循环。其流程如下: 
(1)物质X是_____________(填化学式);在此循环过程中,有一种物质,当作为反应物时只是还原剂,作为生成物时是还原产物,该化合物是__________。
(2)在实验室中进行蒸馏操作时,所需的玻璃仪器为蒸馏烧瓶、温度计、尾接管、锥形瓶、____________。
(3)氧缺位铁酸铜(CuFe2O4-x)可作上述流程中硫酸分解的催化剂。先在一定条件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得铁酸铜( CuFe2O4),此反应的化学方程式为:____________;然后在______(填一常见气体)保护下,高温煅烧2h得到CuFe2O3.86,试计算1 mol CuFe2O3.86中Fe2+的物质的量为____mol。
(4)硫酸分解随温度等变化规律的实验结果如图所示,表示没有使用催化剂的曲线是______(填图中数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某地农田土壤胶体的胶粒带负电荷,若在该农田里施用含氮量相等的下列化肥,有效成分利用率最差的是 ( )。
| A.(NH4)2SO4 | B.NH4HCO3 |
| C.NH4NO3 | D.NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关工业生产的叙述正确的是( )
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com