
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 16gO2和O3的混合气体中所含的原子数为NA | |
| D. | 1mo1•L-1的A1C13溶液中,C1-离子的数目为3NA |
分析 A、标况下四氯化碳为液态;
B、求出2.4g镁的物质的量,然后根据镁反应后变为+2价来分析;
C、氧气和臭氧均由氧原子构成;
D、溶液体积不明确.
解答 解:A、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算,故A错误;
B、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁反应后失去0.2NA个电子,故B正确;
C、氧气和臭氧均由氧原子构成,故16g氧气和臭氧的混合物中含有的氧原子的物质的量为1mol,个数为NA个,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸发溶剂 | B. | 升高温度 | C. | 降低温度 | D. | 加入KN03固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
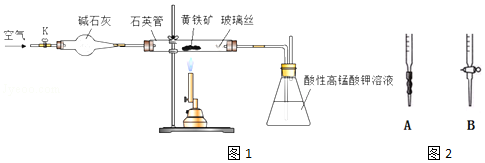
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
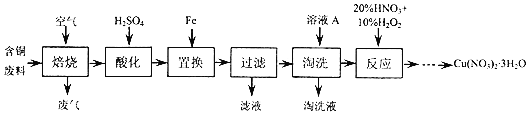

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2O的体积约为22.4L | |
| B. | 106g Na2CO3含有的Na+离子数为2 NA | |
| C. | 常温常压下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol任何粒子的粒子数叫做阿伏加德罗常数,通常用6.02×1023表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体中二氧化碳与一氧化碳的物质的量各为1:1 | |
| B. | 混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是一氧化碳 | |
| C. | 混合气体的平均相对分子质量为36g•mol-1 | |
| D. | 根据题给条件无法计算混合气体在标准状况下的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型为: 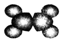 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 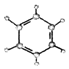 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com