
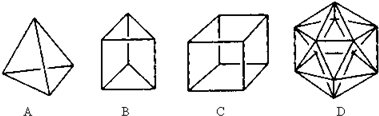
分析 (1)碳原子最外层只有4个电子,最多可形成4个共价键;
(2)根据结构可知最多可插入6个CH2原子团,根据C、H原子数判断分子式;
(3)B的一种同分异构体是最简单的芳香烃应为苯,根据苯的结构判断;
(4)a.环烷烃含饱和键;
b.烃分子中H原子个数不一定都比C原子个数多,如稠环芳香烃;
c.如为烷烃,若知道了某烃的C、H原子个数比,可得出分子式;
d.甲烷的分子式为CH4,烃分子中H%最高的是甲烷.
解答 解:(1)碳原子最外层只有4个电子,达到8电子稳定结构时最多可形成4个共价键,不能形成5个共价键,
故答案为:碳原子不能形成5个共价键;
(2)根据结构可知最多可插入6个CH2原子团,则C应为10个,H应为6×2+4=16,所以分子式为C10H16,
故答案为:C10H16;
(3)最简单的芳香烃应为苯,化学键不是单双键交替,分子中所有碳碳键的键长均相等,它的邻位二元取代物只有一种,可证明该结构特征,而无论是否单双键交替,它的对位二元取代物都只有一种,且在一定条件下都能发生取代反应和加成反应,所以证明的为bc,
故答案为:bc;
(4)a.环烷烃通式为CnH2n,含饱和键,故a错误;
b.烃分子中H原子个数不一定都比C原子个数多,如稠环芳香烃,故b正确;
c.如为烷烃,碳原子化合价达到饱和,若知道了某烃的C、H原子个数比,可得出分子式,故c错误;
d.甲烷的分子式为CH4,烃分子中H%最高的是甲烷,故d正确.
故答案为:bd.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意把握有机物的空间结构和碳原子的成键特点.


科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
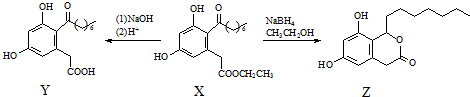
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能发生氧化、还原、取代反应 | |
| C. | 一定条件下,1 mol X最多能与5 mol H2发生加成反应 | |
| D. | 1 mol Z最多可与含3 mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠投入到足量水中 | |
| B. | 将钠用铝箔包好并刺一些小孔,再放入足量水中 | |
| C. | 将钠放入足量稀硫酸中 | |
| D. | 将钠放入足量碳酸氢钠溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向10mL0.1mol/LFeCl2溶液中缓缓通入标准状况下11.2mLCl2 | |
| B. | 向AlC13溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-的溶液中通入NO2 | |
| D. | 向5mL0.1mol/LNaOH溶液中,逐滴加入1mL0.1mol/LAlCl3溶液,边滴加边振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com