
【题目】材料的发展与应用促进了人类社会的进步
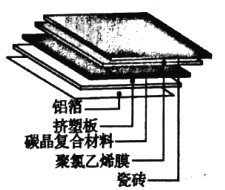
(1)碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是_____;属于硅酸盐材料的是____;属于高分子材料的是挤塑板和______
(2)吸附材料具有多孔、表面积大的特点,活性炭吸附![]() 的过程中,会伴有C与
的过程中,会伴有C与![]() 的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
(3)![]() 是锂离子电池的一种正极材料,可通过
是锂离子电池的一种正极材料,可通过![]() 与
与![]() 煅烧制备,同时还生成
煅烧制备,同时还生成![]() 和一种单质,写出该反应的化学方程式:________
和一种单质,写出该反应的化学方程式:________
(4)某原电池装置如图所示:
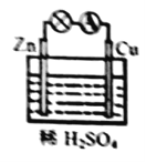
①负极的电极反应式是_______;
②当铜表面析出![]() 氢气(标准状况)时,导线中通过了____
氢气(标准状况)时,导线中通过了____![]() 电子
电子
【答案】铝箔 瓷砖 聚氯乙烯膜 ![]()
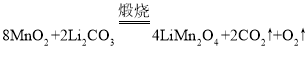
![]() 0.02
0.02
【解析】
(1)铝箔由铝制造,属于金属材料,瓷砖属于硅酸盐材料,聚氯乙烯膜由氯乙烯发生加聚反应制成,属于高分子材料,故答案为:铝箔;瓷砖;聚氯乙烯膜;
(2)结合元素守恒可知,两种常见无毒气体为N2和CO2,所以C和NO2反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)通过![]() 与
与![]() 煅烧制备
煅烧制备![]() ,Mn元素化合价降低,则必有元素化合价升高,所以生成的单质为O2,则该反应的化学方程式为:
,Mn元素化合价降低,则必有元素化合价升高,所以生成的单质为O2,则该反应的化学方程式为: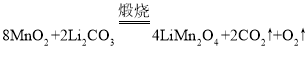 ,故答案为:
,故答案为: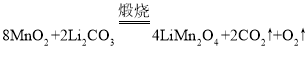 ;
;
(4)①铜锌原电池,Zn为负极,发生的反应为:![]() ,故答案为:
,故答案为:![]() ;
;
②Cu为正极,发生的电极反应为:2H++2e-=H2↑,所以,铜表面析出![]() 氢气(标准状况)时,导线中通过0.02mol电子,故答案为:0.02。
氢气(标准状况)时,导线中通过0.02mol电子,故答案为:0.02。


科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如图。
I
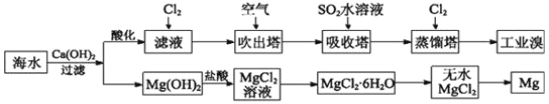
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是______,吸收塔中发生反应的离子方程式是__________。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是____、浓缩、冷却、______、过滤、洗涤、干燥。
II以食盐为原料进行生产并综合利用的某些过程如图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO![]() 离子,加入下列沉淀剂的顺序是(填序号)____。
离子,加入下列沉淀剂的顺序是(填序号)____。
a.BaCl2 b.Na2CO3
(2)NaHCO3制取Na2CO3化学方程式是_____。
(3)将滤液的pH调至酸性除去的离子是______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是_____。
(5)工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是_______。(已知碳酸的酸性强于次氯酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读如图,下列判断正确的是( )
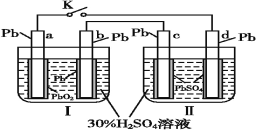
A.K闭合时,d电极的电极反应式:PbSO4+2e-=Pb+ SO42-
B.当电路中通过0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法不正确的是( )
A.在离子晶体中,正、负离子半径比(![]() )越大,晶体的配位数越大
)越大,晶体的配位数越大
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4,阴、阳离子配位数不相等主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2的高主要是因为MgO中的离子键比MgCl2中的离子键强
D.金属晶体和离子晶体都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质C为对甲氧基苯丙酰胺(相对分子质量为179)难溶于冷水的白色晶体,是一种医药中间体,可以由苯甲醚通过两步合成,如下图所示:
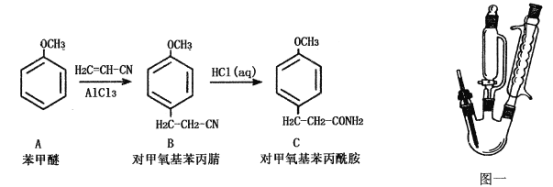
已知:无水三氯化铝遇水会发生强烈水解并放热。
①步骤一:用图一装置合成对甲氧基苯丙腈(B)
在500 mL三颈烧瓶中,加入108 g(1.00 mol)苯甲醚(A),室温下缓慢加入70g(0.52 mol)粉末状三氯化铝,加入过程中温度不超过25℃,加完后降温至5℃,逐滴加入130g(2.45 mol)丙烯腈,滴加结束后再升温至90~95℃,反应2小时。将反应物倒入500g冰水中,搅匀,静置分层,分出油相。减压蒸馏,收集150~160℃/2.67kPa馏分,得到对甲氧基苯丙腈。
②步骤二:对甲氧基苯丙酰胺(C)的合成
将上述反应合成的对甲氧基苯丙腈加入到500 mL三颈烧瓶中,加入300 mL浓盐酸,再经过一系列操作后得对甲氧基苯丙酰胺133.7g。
(1)对甲氧基苯丙腈(B)的合成过程中宜采用的加热方式:____________
(2)图一中合成对甲氧基苯丙腈(B)的装置有一缺陷,请提出改进方法并说明理由:_________
(3)用恒压滴液漏斗加丙烯腈的优点:___________________________________(写出两条);
(4)下列操作为步骤二对甲氧基苯丙酰胺(C)合成过程中加浓盐酸后的一系列操作,请排出下列操作的合理顺序:____________________________________;
①加入活性炭回流0.5h ②趁热过滤 ③抽滤 ④将滤液慢慢倒入1000g冷水中,析出晶体⑤升温至40~50℃,搅拌1h ⑥洗涤、烘干
(5)下列关于实验操作的说法错误的是:__________
A.减压蒸馏采用如图二所示装置,装置中的D为毛细管,也可以用沸石代替
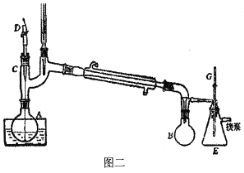
B.减压蒸馏过程中,可以通过控制G处的旋塞停止减压
C.在步骤二,对甲氧基苯丙酰胺(C)的合成过程中,析出的晶体可以用冷水洗涤
D.在步骤二,抽滤后洗涤晶体时,应先关小水龙头,使洗涤剂浸没晶体后,再打开水龙头进行抽滤
E.减压过滤不宜用于过滤颗粒太小的沉淀,因为颗粒太小的沉淀在快速过滤时易透过滤纸
(6)本实验制得的对甲氧基苯丙酰胺的产率为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究化合物A(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
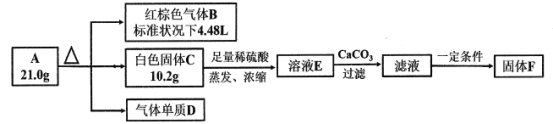
已知:白色固体C既能与强酸反应,也能与强碱反应。
请回答:
(1)写出A受热分解的化学方程式为___________________________________________。
(2)请设计实验方案检验溶液E中所含的阳离子_________________________________。
(3)若固体F中金属元素的百分含量为19.29%,硫为22.86%,氧为57.14%,且300 g/mol<MF<450 g/mol,则F的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:主反应:
a.4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:b.4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
c.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①上述反应中利用了NH3的__________性质;ΔH1=____________。
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图1,试分析脱硝的适宜温度是______(填序号)。
A.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_____________________________________。
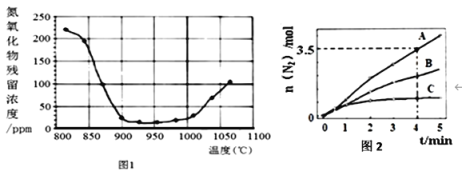
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图2所示。下列说法正确的是_______(填标号)。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图2所示。下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,ΔH值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.8k·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,v正___v逆(填“>”“<”或“=”)。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(分数表示)。
=___________。(分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO![]() =HCO
=HCO![]()
B.草酸(H2C2O4,弱酸)溶液中加入酸性KMnO4溶液: 2MnO![]() +5C2O
+5C2O![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由有机物 a 制备有机物 d 的合成路线如图所示。下列说法正确的是( )

A.a 中的所有原子处于同一平面
B.b 的分子式为C10H12,是乙烯的同系物
C.a 的一氯代物有 3 种,d 的一氯代物有 4 种
D.a、b 均可与酸性高锰酸钾溶液反应,c 与 d 互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com