
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.为了提高含氮量,可以不必考虑施用过程中化肥对土壤产生的不良影响 |
| B.碳铵化肥可以和碱性草木灰混合使用 |
| C.为增强作物的抗寒、抗旱能力,可以适当地施用一些磷肥 |
| D.使用了某一效果显著的杀虫剂后,可以不必更换品牌长期使用 |
查看答案和解析>>
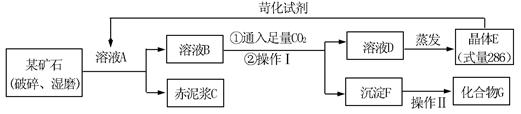
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
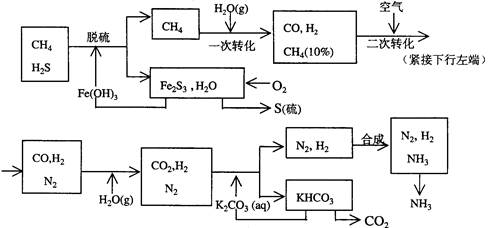
科目:高中化学 来源:不详 题型:填空题

 验方法是 。
验方法是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
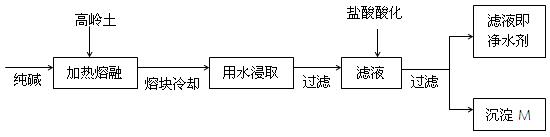
| A.铁坩埚 | B.瓷坩埚 | C.氧化铝坩埚 | D.玻璃坩埚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
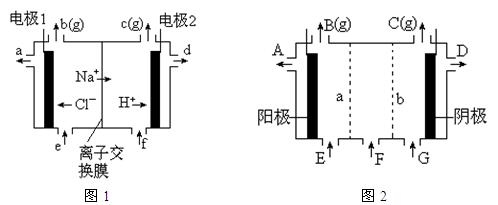
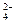 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO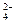 ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题: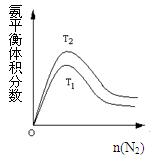
 H
H 2(g)+CO(g) 平衡常数K1
2(g)+CO(g) 平衡常数K1 H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
| A.其它条件不变温度T<900℃ | B.其它条件不变温度T>900℃ |
| C.充入一定量氖气 | D.使用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都使用了合适的催化剂 |
| B.都选择了较高的温度 |
| C.都采用了原料循环使用以提高原料利用率的方法 |
| D.都采用了高压的生产条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com