
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
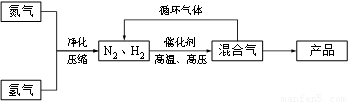
回答下列问题:
(1) 已知: N2(g)
+ O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g)
+ O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g)
+ 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(1) −92.4 kJ/mol 2分 (2) 0.057 (mol·L−1)−2(可不写单位)2分 ①② 2分
(3) ② 两者都是通过改变物质的状态来进行混合物的分离 2分
(4) 8NH3 + 3Cl2 → 6NH4Cl + N2 2分 (5) 25 2分 < 2分
【解析】(1)考查盖斯定律的应用。根据已知反应可知(①×2-②+③×3)÷2即得到N2(g) + 3H2(g)
 2NH3(g),所以△H=(180.5kJ/mol×2+905kJ/mol-483.6kJ/mol×3)÷2=−92.4 kJ/mol。
2NH3(g),所以△H=(180.5kJ/mol×2+905kJ/mol-483.6kJ/mol×3)÷2=−92.4 kJ/mol。
(2)
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
起始量(mol) 1.5 6 0
转化量(mol) x 3x 2x
平衡量(mol) 1.5-x 6-3x 2x
所以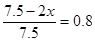
解得x=0.75mol
所以平衡常数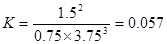 。
。
平衡常数只与温度有关系,所以选项④不正确。催化剂不能影响平衡状态,③不正确。正反应是体积减小的,增大压强平衡向正反应方向移动,增大反应物的浓度平衡也向正反应方向移动,所以答案选①②
(3)氨气易液化,即可以实现气液分离,所以分离方法类似于蒸馏。
(4)氯气极易强氧化性,能把氨气液化生成氮气,而氯气被还原生成氯化氢,氯化氢和氨气反应冒白烟,方程式为8NH3 + 3Cl2 → 6NH4Cl + N2 。
(5)稀释过程中溶质是不变的,所以需取20 mol/L的氨水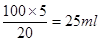 。如果盐酸的pH=14-a。则氨水过量,溶液显碱性。因此要使反应后溶液显中性,则盐酸的pH必须小于14-a。
。如果盐酸的pH=14-a。则氨水过量,溶液显碱性。因此要使反应后溶液显中性,则盐酸的pH必须小于14-a。


科目:高中化学 来源: 题型:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
| H | + 4 |

查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省信阳市高三第二次调研考试化学试卷 题型:填空题
(10分)工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g)回答下列问题:
2NH3(g)回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g); △H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H=_______________。
2NH3(g)的△H=_______________。
(2)(NH4)2SO3和NH4HSO4是两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c( )+c(
)+c( )+c(H2SO3)]=c(
)+c(H2SO3)]=c( )+c(NH3·H2O)
)+c(NH3·H2O)
该同学的依据是:_________________________________________
⑦写出NH4HSO4溶液中离子浓度由大到小的顺序:______________________。
(3)甲烷——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。现用甲烷——空气燃料电池进行下图所示实验(其中a、b均为碳棒):

①Zn片上发生的电极反应式:_____________________。
②a电极的电极反应式_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com