
����Ŀ����ҵ������������ﮣ���������������þ���Ʊ��ķ�������������£�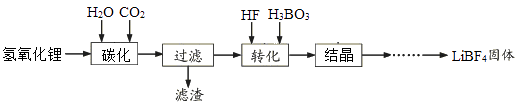
��֪��̼���������ˮ
��1��̼��ʱ��������Ҫ���ӷ���ʽΪ����������Ҫ�ɷ�����(д��ѧʽ)
��������ɴ�ѡ�������������CO2 �� �����ü۸�����˵��������ƣ�����Ҫԭ����
��2��ת�����̷����ķ�ӦΪ�������������ֱ�ΪLiHCO3+HF=LiF��3HF+H2O����д��ѧ����ʽ�����ù����в��ܲ��ò���������ԭ��Ϊ��
��3���ᾧ�õ��ľ���LiBF4��H2O������20�桪50��������150������150������Ŀ������
���𰸡�
��1��LiOH+CO2=Li++HCO3- ��Mg(OH)2��������ͬ��������̼�����������������
��2��LiF��3HF+ H3BO3= LiBF4+ 3H2O��HF ��ʴ����
��3�������ᾧˮ
���������⣺��1����������ȷ��̼��Ŀ����ʹ���ܵ��������ת��Ϊ������ˮ��̼����ﮣ����Է���ʽΪLiOH+CO2=Li++HCO3-;̼��ʱ�������ת��Ϊ̼������ܽ⣬������þ��̼���θ����ܣ������õ�������þ����;�ɴ�Ҫ������Խ��Խ�ã�������ͬ��������̼���������������������������;(2)��Ϊ��Ӧ����������������һ���IJ����ǵڶ����ķ�Ӧ����������յIJ�Ʒ��LiF.3HF+H3BO3=LiBF4+3H2O����Ӧ����HF���룬���ܸ�ʴ���������Բ����ò�������3�������нᾧ�õ��ľ�����нᾧˮ�����ջ����ˮ���壬����Ӧ�ȵ��¸����ȥ����ˮ�֣��ټ��ȳ�ȥ�ᾧˮ��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϸ��ڵ�������Ҫ�ɷ��Ǽ��ᣨ�ṹʽΪ ![]() ��Ka=1.8��10��4����ͨ���������һ����ɫ�ӷ���Һ�壮������Ũ�������������ֽ����CO��ij��ѧ��ȤС���ͬѧ��HCOOH�����ʽ���������̽����
��Ka=1.8��10��4����ͨ���������һ����ɫ�ӷ���Һ�壮������Ũ�������������ֽ����CO��ij��ѧ��ȤС���ͬѧ��HCOOH�����ʽ���������̽����
��1������ͬѧѡ����ͼ1��ʾ��װ��̽��HCOOH��Ũ���������·ֽ������CO����������и�С�⣮ 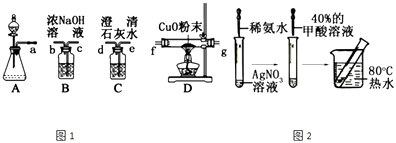
��i��д������ֽ�Ļ�ѧ����ʽ��
��ii��װ�õ�����˳��a��
��iii��HCOOH�ķֽ��������CO��������
��iv����ʵ�������һ�����Ե�ȱ������
��2������ͬѧ�����˼�����ӽṹ����Ϊ�����ܷ���������Ӧ�����������ͼ2��ʾ��ʵ�飮
��i����ͼ��ʾ��ʵ�飬����20���Ӻ�û�г��ֹ����������������ʵ����û�в���������ԭ����
��ii�������ʵ������֤��Ľ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪʵ������ȡ���ռ��������������������������������ʵ���װ��ͼ�� 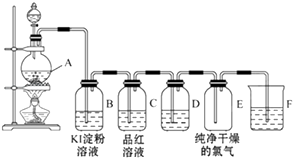
��1����Ӧǰ����װ��A��װŨ���ᣨ��д�������ƣ�װMnO2����д�������ƣ�װ��A�з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��װ��B�е���������Ӧ�Ļ�ѧ����ʽΪ ��
��3��װ��D����װ�Լ��� �� ������
��4��װ��F�з�����Ӧ�Ļ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������M����ҩ�ǰѲݵijɷ�֮һ������������ɱ�����ã�M�Ľṹ��ͼ��ʾ������������ȷ���ǣ� �� 
A.M��Ħ��������180g/mol
B.1 mol M�������2 mol Br2������Ӧ
C.1 mol M������NaHCO3��Ӧ������4 mol CO2
D.M��������NaOH��Һ������Ӧʱ�������л�����Ļ�ѧʽΪC9H4O5Na4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��Zn��s��+ ![]() O2��g���TZnO��s����H=��348.3kJmol��1 �� ��2��2Ag��s��+
O2��g���TZnO��s����H=��348.3kJmol��1 �� ��2��2Ag��s��+ ![]() O2��g���TAg2O��s����H=��31.0kJmol��1 �� ��Zn��s��+Ag2O��s���TZnO��s��+2Ag��s���ġ�H���ڣ� ��
O2��g���TAg2O��s����H=��31.0kJmol��1 �� ��Zn��s��+Ag2O��s���TZnO��s��+2Ag��s���ġ�H���ڣ� ��
A.��379.3kJmol��1
B.��317.3kJmol��1
C.��332.8kJmol��1
D.317.3kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ҵ���������ײ�����ҵ�����ϡ���'���Ϊ����̽�������ǻ�ѧ����Ҫ��ɵģ�ij�����Ĺ��˷����к���ͭ�������������������Ʊ�CuSO45H2O��Fe SO47H2O��AlCl3������ͼ�� 
��1����AlCl3��Һ���ɲ����գ��õ��IJ����� ��
��2��д��A��C�Ļ�ѧ����ʽ�� ��
��3��������ҺD�еĽ��������ӵķ�����
��4��д��E��CuSO4�Ļ�ѧ����ʽ�� ��
��5��д���������ռӦ�����ӷ���ʽ�� ��
��6��ȡ������ҺD�������м���˫��ˮ������Ϊ�� ��
��7����CuSO4��Һ����ͭ�ľ���Һ�������Ϸ����ĵ缫��ӦʽΪ�� ��
��8���ƺ������ǻ��ý�����д�����������ƵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ķ�����һ����ȵ��ǣ� ��
A.������ȡ��ܶȲ�ͬ��N2��C2H4
B.�����ȵ�CO��N2
C.���¡��������O2��N2
D.��ѹ���������N2��CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Se����һ���п��������������õ�Ԫ�أ������γɶ��ֻ���� 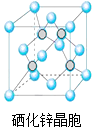
��1����̬��ԭ�ӵļ۲�����Ų�ʽΪ ��
��2���ࡢ�顢���ĵ�һ�����ܴ�С����Ϊ ��
��3��H2SeO3������ԭ���ӻ���������SeO32�������幹���� �� ��SeO42����Ϊ�ȵ���ķ����У�дһ�����ʵĻ�ѧʽ���ɣ� ��
��4��H2Se����������Ի�Ǽ��ԣ����ӣ����������۵�Ϊ217�棬���������壮
��5������п��һ����Ҫ�İ뵼����ϣ��侧���ṹ��ͼ��ʾ�����þ����ܶ�Ϊ��gcm��3 �� ����п��Ħ������ΪM g/mol��NA���������ӵ�������������aΪpm��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com