
”¾ĢāÄæ”æĶµ„ÖŹ¼°Ęä»ÆŗĻĪļŌŚŗܶąĮģÓņÖŠ¶¼ÓŠÖŲŅŖµÄÓĆĶ¾”£Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
(1)³¬ĻøĶ·ŪæÉÓĆ×÷µ¼µē²ÄĮĻ”¢“߻ƼĮµČ£¬ĘäÖʱø·½·ØČēĻĀ£ŗ

¢ŁNH4CuSO3ÖŠ½šŹōŃōĄė×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ__________________”£N”¢O”¢SČżÖÖŌŖĖŲµÄµŚŅ»µēĄėÄÜ“óŠ”Ė³ŠņĪŖ____________(ĢīŌŖĖŲ·ūŗÅ)”£
¢ŚĻņCuSO4ČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£¬æÉÉś³É[Cu(NH3)4]SO4£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________”£
A£®°±Ęų¼«Ņ×ČÜÓŚĖ®£¬ŌŅņÖ®Ņ»ŹĒNH3·Ö×ÓŗĶH2O·Ö×ÓÖ®¼äŠĪ³ÉĒā¼üµÄŌµ¹Ź
B£®NH3·Ö×ÓŗĶH2O·Ö×Ó£¬·Ö×Óæռ乹ŠĶ²»Ķ¬£¬°±Ęų·Ö×ӵļü½ĒŠ”ÓŚĖ®·Ö×ӵļü½Ē
C£®[Cu(NH3)4]SO4ČÜŅŗÖŠ¼ÓČėŅŅ“¼£¬»įĪö³öÉīĄ¶É«µÄ¾§Ģå
D£®ŅŃÖŖ3.4 g°±ĘųŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉĪŽĪŪČ¾µÄĘųĢ壬²¢·Å³öa kJČČĮ棬ŌņNH3µÄČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗNH3(g)£«3/4O2(g)===1/2N2(g)£«3/2H2O(g)””¦¤H£½£5a kJ”¤mol£1
(2)ĶĆĢŃõ»ÆĪļ(CuMn2O4)ÄÜŌŚ³£ĪĀĻĀ“ß»ÆŃõ»ÆæÕĘųÖŠµÄŃõĘų±äĪŖ³ōŃõ(ÓėSO2»„ĪŖµČµē×ÓĢå)”£øł¾ŻµČµē×ÓŌĄķ£¬O3·Ö×ÓµÄæռ乹ŠĶĪŖ________”£
(3)ĀČÓė²»Ķ¬¼ŪĢ¬µÄĶæÉÉś³ÉĮ½ÖÖ»ÆŗĻĪļ£¬ĘäŅõĄė×Ó¾łĪŖĪŽĻŽ³¤Į“½į¹¹(ČēĶ¼ĖłŹ¾)£¬aĪ»ÖĆÉĻClŌ×Ó(ŗ¬ÓŠŅ»øöÅäĪ»¼ü)µÄŌӻƹģµĄĄąŠĶĪŖ____________________”£

(4)ČēĶ¼ŹĒ½šŹōCaŗĶDĖłŠĪ³ÉµÄijÖÖŗĻ½šµÄ¾§°ū½į¹¹Ź¾ŅāĶ¼£¬ŅŃÖŖļēÄųŗĻ½šÓėÉĻŹöCa£DŗĻ½š¶¼¾ßÓŠĻąĶ¬ĄąŠĶµÄ¾§°ū½į¹¹XYn£¬ĖüĆĒÓŠŗÜĒæµÄ“¢ĒāÄÜĮ¦”£ŅŃÖŖļēÄųŗĻ½šLaNin¾§°ūĢå»żĪŖ9.0”Į10£23 cm3£¬“¢ĒāŗóŠĪ³ÉLaNinH4.5ŗĻ½š(Ēā½ųČė¾§°ūæÕĻ¶£¬Ģå»ż²»±ä)£¬ŌņLaNinÖŠn£½______________________(ĢīŹżÖµ)£»ĒāŌŚŗĻ½šÖŠµÄĆܶČĪŖ________(±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö)”£

”¾“š°ø”æ1s22s22p63s23p63d10(»ņ[Ar]3d10) N£¾O£¾S AC VŠĪ sp3ŌÓ»Æ 5 0.083 g”¤cm£3
”¾½āĪö”æ
£Ø1£©¢ŁNH4CuSO3ÖŠ½šŹōŃōĄė×ÓĪŖCu+£¬ĶŹĒ29ŗÅŌŖĖŲ£¬Ź§Č„Ņ»øöµē×ÓÉś³ÉŃĒĶĄė×Ó£»NŌ×Ó2p¹ģµĄĪŖ°ė³äĀś½į¹¹£¬µŚŅ»µēĄėÄÜ“óÓŚOŌ×Ó£¬Ķ¬Ņ»Ö÷×åŌŖĖŲµÄµŚŅ»µēĄėÄÜĖę×ÅŌ×ÓŠņŹżµÄŌö“ó¶ų¼õŠ”£»
A”¢°±Ęų·Ö×ÓÓėĖ®·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£»
B”¢°±Ęų·Ö×ÓÖŠNŌ×ÓŗĶĖ®·Ö×ÓOŌ×Ó¾łĪŖsp3Ōӻƣ¬°±·Ö×ÓÖŠNŌ×ÓÖ»ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬Ė®·Ö×ÓÖŠOŌ×ÓÓŠĮ½¶Ō¹Ā¶Ōµē×Ó£»
C”¢øł¾ŻĻąĖĘĻąČÜæÉÖŖ£¬ŅŅ“¼·Ö×Ó¼«ŠŌČõÓŚĖ®µÄ¼«ŠŌ£»
D”¢Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ÖŠ£¬²śĪļH2OĪŖŅŗĢ¬£»
£Ø2£©O3·Ö×ÓÓėSO2»„ĪŖµČµē×ÓĢ壬µČµē×ÓĢå¾ßÓŠĻąĶ¬µÄæռ乹ŠĶ£»
£Ø3£©aĪ»ÖĆÉĻµÄClŠĪ³ÉĮĖ2Ģõµ„¼ü£¬»¹ÓŠ2¶Ō¹Ā¶Ōµē×Ó£»
£Ø4£©ÓÉĶ¼æÉÖŖ£¬ŌŚ¾§°ūÉĻ”¢ĻĀĮ½øöĆęÉĻ¹²ÓŠ4øöDŌ×Ó£¬ŌŚĒ°”¢ŗó”¢×ó”¢ÓŅĖÄøöĆęÉĻ¹²ÓŠ4øöDŌ×Ó£¬ŌŚ¾§°ūµÄÖŠŠÄ»¹ÓŠŅ»øöDŌ×Ó”£
£Ø1£©¢ŁNH4CuSO3ÖŠ½šŹōŃōĄė×ÓĪŖCu+£¬ĶŹĒ29ŗÅŌŖĖŲ£¬øł¾ŻÄÜĮæ×īµĶŌĄķĘäĢ¬Ō×ӵĵē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p63d104s1»ņ[Ar]3d104s1£¬øĆŌ×ÓŹ§Č„Ņ»øöµē×ÓŹ±£¬Éś³ÉŃĒĶĄė×Ó£¬Ź§Č„µÄµē×ÓŹĒ×īĶā²ćµē×Ó£¬ĖłŅŌŃĒĶĄė×ӵĻłĢ¬µÄµē×ÓÅŲ¼Ź½ĪŖ£ŗ1S22S22P63S23P63d10»ņ[Ar]3d10£»NŌ×Ó2p¹ģµĄĪŖ°ė³äĀś½į¹¹£¬µŚŅ»µēĄėÄÜ“óÓŚOŌ×Ó£¬Ķ¬Ņ»Ö÷×åŌŖĖŲµÄµŚŅ»µēĄėÄÜĖę×ÅŌ×ÓŠņŹżµÄŌö“ó¶ų¼õŠ”£¬ĖłŅŌĘ䵌Ņ»µēĄėÄÜ“óŠ”ĪŖN£¾O£¾S£¬¹Ź“š°øĪŖ£ŗ1S22S22P63S23P63d10»ņ[Ar]3d10£»N£¾O£¾S£»
¢ŚA”¢°±Ęų·Ö×ÓÓėĖ®·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£¬Ēā¼üµÄ“ęŌŚŹ¹ĪļÖŹµÄČܽāŠŌĻŌÖųŌö“󣬹ŹÕżČ·£»
B”¢°±Ęų·Ö×ÓÖŠNŌ×ÓŗĶĖ®·Ö×ÓOŌ×Ó¾łĪŖsp3Ōӻƣ¬°±·Ö×ÓÖŠNŌ×ÓÖ»ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬Ė®·Ö×ÓÖŠOŌ×ÓÓŠĮ½¶Ō¹Ā¶Ōµē×Ó£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪæÉÖŖ£¬°±·Ö×ӵļü½Ē“óÓŚĖ®·Ö×ӵļü½Ē£¬¹Ź“ķĪó£»
C”¢øł¾ŻĻąĖĘĻąČÜæÉÖŖ£¬ŅŅ“¼·Ö×Ó¼«ŠŌČõÓŚĖ®µÄ¼«ŠŌ£¬[Cu(NH3)4]SO4ŌŚŅŅ“¼ÖŠČܽā¶Č½µµĶ£¬Ōņ[Cu(NH3)4]SO4ČÜŅŗÖŠ¼ÓČėŅŅ“¼»įĪö³öÉīĄ¶É«µÄ¾§Ģ壬¹ŹÕżČ·£»
D”¢±ķŹ¾Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ÖŠ£¬²śĪļH2OĪŖŅŗĢ¬£¬¹Ź“ķĪó£»
¹ŹŃ”AC£¬¹Ź“š°øĪŖ£ŗAC£»
£Ø2£©O3·Ö×ÓÓėSO2»„ĪŖµČµē×ÓĢ壬SO2·Ö×ÓÖŠSŌ×Ó¼Ū²ćµē×Ó¶ŌŹżĪŖ3£¬¹Ā¶Ōµē×ÓŹżĪŖ1£¬æռ乹ŠĶĪŖVŠĪ£¬µČµē×ÓĢå¾ßÓŠĻąĶ¬µÄæռ乹ŠĶ£¬ŌņO3·Ö×Óæռ乹ŠĶĪŖVŠĪ£¬¹Ź“š°øĪŖ£ŗVŠĪ£»
£Ø3£©aĪ»ÖĆÉĻµÄClŠĪ³ÉĮĖ2Ģõµ„¼ü£¬»¹ÓŠ2¶Ō¹Ā¶Ōµē×Ó£¬¹ŹĪŖsp3Ōӻƣ¬¹Ź“š°øĪŖ£ŗsp3Ōӻƣ»
£Ø4£©ļēÄųŗĻ½š”¢Ca£DŗĻ½š¶¼¾ßÓŠĻąĶ¬ĄąŠĶµÄ¾§°ū½į¹¹XYn£¬ÓÉĶ¼æÉÖŖ£¬ŌŚ¾§°ūÉĻ”¢ĻĀĮ½øöĆęÉĻ¹²ÓŠ4øöDŌ×Ó£¬ŌŚĒ°”¢ŗó”¢×ó”¢ÓŅĖÄøöĆęÉĻ¹²ÓŠ4øöDŌ×Ó£¬ŌŚ¾§°ūµÄÖŠŠÄ»¹ÓŠŅ»øöDŌ×Ó£¬¹ŹCaÓėDµÄøöŹż±ČĪŖ8”Į![]() £ŗ£Ø8”Į
£ŗ£Ø8”Į![]() +1£©=1£ŗ5£¬¹Źn=5£»¾§°ūĢå»żĪŖ9.0”Į10-23cm3£¬LaNinH4.5ŗĻ½šÖŠHµÄÖŹĮæĪŖ
+1£©=1£ŗ5£¬¹Źn=5£»¾§°ūĢå»żĪŖ9.0”Į10-23cm3£¬LaNinH4.5ŗĻ½šÖŠHµÄÖŹĮæĪŖ![]() =
=![]() £¬ĒāŌŚŗĻ½šÖŠµÄĆܶČĪŖ
£¬ĒāŌŚŗĻ½šÖŠµÄĆܶČĪŖ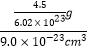 =0.083 g”¤cm£3£¬¹Ź“š°øĪŖ£ŗ0.083 g”¤cm£3”£
=0.083 g”¤cm£3£¬¹Ź“š°øĪŖ£ŗ0.083 g”¤cm£3”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬ĻĀĮŠø÷×éĄė×ÓŌŚÖø¶ØČÜŅŗÖŠÄÜ“óĮæ¹²“ęµÄŹĒ
A. 0.1 mol”¤L1NaOHČÜŅŗ£ŗNa+”¢K+”¢![]() ”¢
Ӣ![]()
B. 0.1 mol”¤L1FeCl2ČÜŅŗ£ŗK+”¢Mg2+”¢![]() ”¢
Ӣ![]()
C. 0.1 mol”¤L1K2CO3ČÜŅŗ£ŗNa+”¢Ba2+”¢Cl”¢OH
D. 0.1 mol”¤L1H2SO4ČÜŅŗ£ŗK+”¢![]() ”¢
Ӣ![]() Ӣ
Ӣ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¢ŁCH3CH2CH3 ¢ŚCH3CH2CH2CH3 ¢ŪCH3CH2CH2CH2CH3 ¢Ü![]()
¢Ż ¢ŽCH3CH2CH2CH2CH2CH3
¢ŽCH3CH2CH2CH2CH2CH3
ÉĻŹöĪļÖŹµÄ·Šµć°“ÓÉøßµ½µĶµÄĖ³ŠņÅÅĮŠµÄŹĒ£Ø £©
A. ¢Ž¢Ū¢Ü¢Ż¢Ś¢Ł B. ¢Ž¢Ū¢Ś¢Ł¢Ü¢Ż C. ¢Ż¢Ü¢Ž¢Ū¢Ś¢Ł D. ¢Ž¢Ż¢Ü¢Ū¢Ś¢Ł
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æLi4Ti5O12ŗĶLiFePO4¶¼ŹĒļ®Ąė×Óµē³ŲµÄµē¼«²ÄĮĻ£¬æÉĄūÓĆīŃĢśæó£ØÖ÷ŅŖ³É·ÖĪŖFeTiO3£¬»¹ŗ¬ÓŠÉŁĮæMgO”¢SiO2µČŌÓÖŹ£©Ą“Öʱø£¬¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
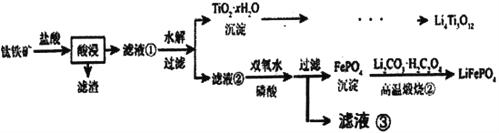
ŅŃÖŖ£ŗ”°Ėį½ž”±ŗó£¬īŃÖ÷ŅŖŅŌTiOCl42-ŠĪŹ½“ęŌŚ
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. Li2Ti5O15ÖŠTiµÄ»ÆŗĻ¼ŪĪŖ+4£¬ĘäÖŠÓŠ4øö¹żŃõ¼ü
B. ĀĖŅŗ¢ŚÖŠµÄŃōĄė×Ó³żĮĖFe2+ŗĶH+£¬»¹ÓŠMg2+
C. ĀĖŅŗ¢ŚÖŠŅ²æÉŅŌÖ±½Ó¼ÓŹŹĮæµÄĀČĖ®“śĢęĖ«ŃõĖ®
D. ”°øßĪĀģŃÉÕ¢Ś”±¹ż³ĢÖŠ£¬FeŌŖĖŲ±»Ńõ»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ×ĖįĢśļ®µē³ŲŹĒŠĀŠĶµÄĀĢÉ«ÄÜŌ“µē³Ų£¬Ęä¼ņ»ÆµÄÉś²ś¹¤ŅÕĮ÷³ĢČēĻĀ”£
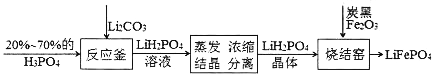
(1)·“Ó¦øŖÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______£¬øĆ·“Ó¦ĢåĻÖ³ö·Ē½šŹōŠŌ¹ŲĻµ£ŗP_____C(Ģī”°>”±»ņ”°<”±)”£
(2)ŹŅĪĀĻĀ£¬LiH2PO4ČÜŅŗµÄpHĖęc(H2PO4-)µÄ±ä»ÆČēĶ¼1ĖłŹ¾£¬H3PO4ČÜŅŗÖŠH2PO4-µÄ·Ö²¼·ÖŹż![]() ĖępHµÄ±ä»ÆČēĶ¼2ĖłŹ¾[
ĖępHµÄ±ä»ÆČēĶ¼2ĖłŹ¾[![]() (ŗ¬PŌŖĖŲµÄĮ£×Ó)]”£
(ŗ¬PŌŖĖŲµÄĮ£×Ó)]”£
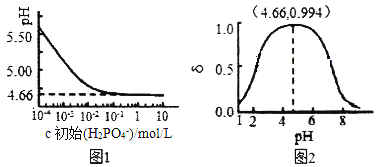
¢ŁÓÉĶ¼1ÖŖ£¬µĶÅØ¶ČŹ±LiH2PO4ČÜŅŗµÄpHŠ”ÓŚ7£¬ĒŅĖę×Åc³õŹ¼(H2PO4-)µÄŌö“ó¶ų¼õŠ”£¬ĘäŗĻĄķµÄ½āŹĶĪŖ__________________”£
¢Ś×ŪŗĻÉĻĶ¼·ÖĪö£¬ČōÓĆÅØ¶Č“óÓŚ1mol/LµÄH3PO4ČÜŅŗČܽāLi2CO3£¬ŅŖŹ¹·“Ó¦øŖÖŠµÄH3PO4¼øŗõČ«²æ×Ŗ»Æ³ÉLiH2PO4£¬·“Ó¦øŖÖŠŠčŅŖæŲÖĘČÜŅŗµÄpH=________”£
(3)Į×ĖįĢśļ®µē³Ų×Ü·“Ó¦ĪŖ£ŗLiFePO4+6C![]() Li1-xFePO4+LixC6£¬µē³ŲÖŠµÄ¹ĢĢåµē½āÖŹæÉ“«µ¼Li+”£³äµēŹ±£¬Li+ŅĘĻņ______(Ģī”°Ńō¼«”±»ņ”°Ņõ¼«”±)£»·ÅµēŹ±£¬Õż¼«·“Ó¦Ź½ĪŖ__________________”£
Li1-xFePO4+LixC6£¬µē³ŲÖŠµÄ¹ĢĢåµē½āÖŹæÉ“«µ¼Li+”£³äµēŹ±£¬Li+ŅĘĻņ______(Ģī”°Ńō¼«”±»ņ”°Ņõ¼«”±)£»·ÅµēŹ±£¬Õż¼«·“Ó¦Ź½ĪŖ__________________”£
(4)Į×ĖįĢśļ®µē³ŲÖŠĢśµÄŗ¬ĮææÉĶعżČēĻĀ·½·Ø²ā¶Ø£ŗ³ĘČ”1.60gŹŌŃłÓĆŃĪĖįČܽā£¬ŌŚČÜŅŗÖŠ¼ÓČėÉŌ¹żĮæµÄSnCl2ČÜŅŗ£¬ŌŁ¼ÓČėHgCl2±„ŗĶČÜŅŗ£¬Óƶž±½°·»ĒĖįÄĘ×÷ÖøŹ¾¼Į£¬ÓĆ0.030mol/LÖŲøõĖį¼ŲČÜŅŗµĪ¶ØÖĮČÜŅŗÓÉĒ³ĀĢÉ«±äĪŖĄ¶×ĻÉ«£¬ĻūŗÄÖŲøõĖį¼ŲČÜŅŗ50.00mL”£
ŅŃÖŖ£ŗ2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
¢ŁŹµŃéÖŠ¼ÓČėHgCl2±„ŗĶČÜŅŗµÄÄæµÄŹĒ____________”£
¢ŚĢśµÄ°Ł·Öŗ¬ĮæFe(£„)=_________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆ»ÆѧÓĆÓļ±ķŹ¾2Na+2H2OØT2NaOH+H2”üÖŠµÄĻą¹ŲĪ¢Į££¬ĘäÖŠÕżČ·µÄŹĒ(””””)
A. ÖŠ×ÓŹżĪŖ8µÄŃõŌ×Ó£ŗ88O
B. NaOHµÄµē×ÓŹ½£ŗ![]()
C. H2OµÄ½į¹¹Ź½£ŗ![]()
D. Na+µÄ½į¹¹Ź¾ŅāĶ¼£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚČČ»Æѧ·“Ó¦µÄĆčŹöÖŠÕżČ·µÄŹĒ
A. HClŗĶNaOH·“Ó¦µÄÖŠŗĶČČ”÷H£½£57.3 kJ”¤mol1£¬ŌņH2SO4ŗĶCa(OH)2·“Ó¦µÄÖŠŗĶČČ”÷H=2”Į(£57.3)kJ”¤mol1
B. ¼×ĶéµÄ±ź×¼Č¼ÉÕČȦ¤H£½£890.3 kJ”¤mol1£¬ŌņCH4(g)£«2O2(g)£½CO2(g)£«2H2O(g) ¦¤H£¼£890.3 kJ”¤mol1
C. ŅŃÖŖ£ŗ500”ę”¢30MPaĻĀ£¬N2(g)£«3H2(g)![]() 2NH3(g) ¦¤H£½£92.4kJ”¤mol£1£»½«1.5 mol H2ŗĶ¹żĮæµÄN2ŌŚ“ĖĢõ¼žĻĀ³ä·Ö·“Ó¦£¬·Å³öČČĮæ46.2 kJ
2NH3(g) ¦¤H£½£92.4kJ”¤mol£1£»½«1.5 mol H2ŗĶ¹żĮæµÄN2ŌŚ“ĖĢõ¼žĻĀ³ä·Ö·“Ó¦£¬·Å³öČČĮæ46.2 kJ
D. CO(g)µÄČ¼ÉÕČČŹĒ283.0kJ”¤mol1£¬Ōņ2CO2(g) ===2CO(g)+O2(g)·“Ó¦µÄ”÷H£½+566.0 kJ”¤mol1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ²ŻĖį(H2C2O4)ŹĒŅ»ÖÖ¶žŌŖČõĖį”£³£ĪĀĻĀ£¬ĻņH2C2O4ČÜŅŗÖŠÖšµĪ¼ÓČėNaOHČÜŅŗ£¬»ģŗĻČÜŅŗÖŠlgX[XĪŖc(HC2O4-)/c(H2C2O4)»ņc(C2O42-)/c(HC2O4-)]ÓėpHµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØŅ»¶ØÕżČ·µÄŹĒ(””””)

A. ¢ń±ķŹ¾lgc(HC2O4-)/c(H2C2O4)ÓėpHµÄ±ä»Æ¹ŲĻµ
B. pH£½1.22µÄČÜŅŗÖŠ£ŗ2c(C2O42©)+c(HC2O4©)£¾c(Na+)
C. 1.22£¼pH£¼4.19µÄČÜŅŗÖŠ£ŗc(HC2O4©)£¾c(C2O42©)£¾c(H2C2O4)
D. pH£½4.19µÄČÜŅŗÖŠ£ŗc(Na+)£½3c(HC2O4©)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼±ķŹ¾ČÜŅŗÖŠc£ØH+£©ŗĶc£ØOH©£©µÄ¹ŲĻµ£¬ĻĀĮŠÅŠ¶Ļ“ķĪóµÄŹĒ

A. Į½ĢõĒśĻß¼äČĪŅāµć¾łÓŠc£ØH+£©”Įc£ØOH©£©£½KW
B. MĒųÓņÄŚČĪŅāµć¾łÓŠc£ØH+£©£¼c£ØOH©£©
C. Ķ¼ÖŠT1£¼T2
D. XZĻßÉĻČĪŅāµć¾łÓŠpH£½7
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com