
分析 (1)①室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,MOH为弱碱,含有弱根离子的盐促进水电离;
②根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)计算,质子守恒为c(H+)=c(MOH)+c(OH-),溶液PH=6,计算溶液中氢离子浓度和氢氧根离子浓度,计算得到有关离子浓度;
(2)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,
解答 解:(1)①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐MCl溶液呈酸性,说明该盐是强酸弱碱盐,MOH为弱碱,含有弱碱阳离子的盐促进水电离,M++H2O?MOH+H+,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol•L-1 HCl溶液中水电离出的c(H+),
故答案为:>;
②混合溶液的pH=6,c(H+)=10-6mol/l,离子积常数计算得到氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8mol/L,根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol•L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol•L-1,
故答案为:9.9×10-7;1.0×10-8;
(2)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,MOH+HCl=MCl+H2O,得到溶液中的溶质是等浓度的MCl和MOH,测得混合溶液的pH<7,溶液显酸性,MCl水解显酸性,说明碱MOH的电离程度小于盐MCl的水解程度,
故答案为:<;
点评 本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据电荷守恒和质子守恒分析弱电解质的电离及盐类水解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
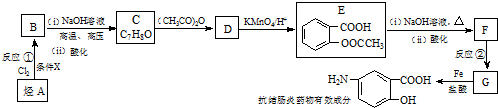
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$ (b)
(b)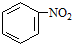 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 ;
;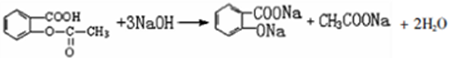 ;
; ;
; )易被氧化,苯环上连有烷基时再引入一个取代基,常取代
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代 ) 合成路线中两种中间产物的结构简式(部分反应条
) 合成路线中两种中间产物的结构简式(部分反应条 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
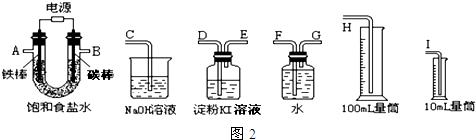
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
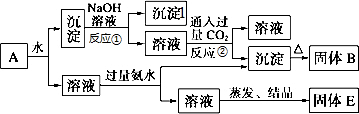
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
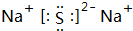 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
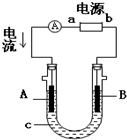 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A. | 实验①中铁钉只做还原剂 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com