

 .
. 分析 (1)由元素在周期表中位置,可知①为C、②为O、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S;
(2)同周期自左而右原子半径减小;
(3)钠元素焰色反应呈黄色;
(4)⑥为Al,原子核外电子数为13,有3个电子层,各层电子数为2、8、3.
解答 解:由元素在周期表中位置,可知①为C、②为O、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S.
(1)②为氧元素,故答案为:氧;
(2)同周期自左而右原子半径减小,故原子半径:C>O>F,故答案为:C;
(3)④为Na钠元素,钠的化合物在无色火焰上灼烧时火焰呈黄色,故答案为:黄;
(4)⑥为Al,原子核外电子数为13,有3个电子层,各层电子数为2、8、3,原子结构示意图为 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表与元素周期律,比较基础,旨在考查学生对基础知识的理解掌握.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:解答题
 某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..
某同学在研究前18号元素时发现,可以将它们按原子序数递增的顺序排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素..| 共价键 | H-F | H-Cl | H-O | H-S | H-N | H-P |
| 键长(pm) | 92 | 127 | 98 | 135 | 101 | 321 |
| 键能(kJ•mol-1) | 568 | 432 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )分子的一氯代物有2种.
)分子的一氯代物有2种. 系统命名为3-甲基-2-乙基-1-丁烯
系统命名为3-甲基-2-乙基-1-丁烯 请写出其单体结构:
请写出其单体结构: 、
、 、
、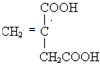 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,在过氧化钠晶体中阴、阳离子的个数比为1:2;
,在过氧化钠晶体中阴、阳离子的个数比为1:2;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D
(1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2发生氧化反应 | B. | 碘电极为该电池的负极 | ||
| C. | 正极反应为:Li-e-═Li+ | D. | 该电池放电时化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.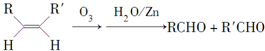
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com