
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是( )
| A.自来水 | B.0.5mol·L—1KOH溶液 |
| C.0.5mol·L—1醋酸 | D.0.5mol·L—1NH4Cl溶液 |
科目:高中化学 来源: 题型:实验题
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |



查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为
| A.9:2 | B.2:9 | C.1:9 | D.10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验事实所得出的结论中,错误的是( )
| A.向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 |
| B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- |
| C.先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42- |
| D.盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中有关物质的量浓度关系正确的是( )
A.0.1 mol/L pH=3的H2A溶液与0.01 mol/L pH=11的MOH溶液任意比混合:
c(H+)+c(M+)=c(OH-)+2c(A2-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
| A.对比等浓度的两种酸的pH |
| B.对比等浓度的两种酸,与相同大小镁条反应的初始速率 |
| C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 |
| D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,已知0.1mol·L-1的CH3COOH和HCN溶液的PH分别为a、b,且1<a< b。下列有关叙述不正确的是( )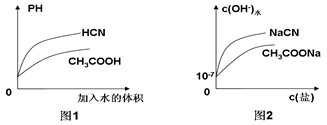
| A.常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小 |
| B.在NaCN溶液中:c (Na+)+ c (H+) =c (OH-)+ c (CN-) |
| C.相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示 |
| D.常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液一定呈中性的是( )
| A.c(H+)=c(OH-)=10-6mol/L溶液 | B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 | D.酸与碱恰好完全反应生成正盐的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.将25℃纯水加热至95℃时,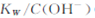 增大 增大 |
B.将pH=11的Na2CO3溶液加水稀释, 增大 增大 |
| C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14" |
| D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则 |
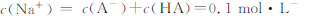
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com