
分析 (1)配制一定浓度的溶液必须使用的仪器是容量瓶;
(2)弱电解质的电离是可逆的,不能完全电离,等pH的一元强酸和一元弱酸中,弱酸的浓度大于强酸;
(3)弱酸的强碱盐可以水解,水解显示碱性.
解答 解:(1)在方案的第①步中,称取一定质量的HA配制0.lmol/L的溶液100mL,根据配制一定浓度的溶液必须使用容量瓶,故答案为:100mL的容量瓶、量筒、天平;
(2)配制0.1mol/L的HA酸溶液100mL,弱电解质的电离是可逆的,不能完全电离,用pH试纸测出该溶液的pH值,如果是pH>1即为弱酸,pH=1即为强酸,各取相同体积、pH=1的两种酸溶液装入两个试管,同时加入纯度相同的锌粒,装HA溶液的试管中入出H2的速率快,故答案为:>;b;
(3)弱酸的强碱盐可以水解,水解显示碱性,可以配制NaA溶液,如果测定其pH>7,即可以证明HA是弱电解质,
答:配制NaA溶液,测定pH>7,即可以证明HA是弱电解质.
点评 本题是一道有关电解质的电离知识的综合应用题,考查学生分析和解决问题的能力,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na与H2O反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 工业制备氯气:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++2OH-+H2↑+Cl2↑ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液中滴入AgNO3溶液 | B. | 氢气还原氧化铜 | ||
| C. | 铁片置于CuSO4溶液中 | D. | 一氧化碳的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应都是置换反应 | B. | 据反应条件无法判断反应是否吸热 | ||
| C. | 两个反应互为可逆反应 | D. | 两个反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
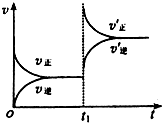 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄砷的熔点高于白磷 | B. | 黄砷中共价键键能大于白磷 | ||
| C. | 黄砷分子极性大于白磷 | D. | 分子中共价键键角均为109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
| ②向新制的H 2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
| ④镁带与2molL -1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2molL -1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
| 实验方案* | 实验现象* | 有关化学方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com