
【题目】某同学想利用原电池反应检测Zn和Cu的金属活动性顺序.请你帮他选择适宜的材料和试剂设计一个原电池,并完成下列实验报告:
实验目的:探究Zn和Cu的金属活动性顺序
(1)电极材料:正极:;负极:;电解质溶液: .
(2)写出电极反应式:正极:;负极: .
(3)画出装置图:
(4)实验现象: .
(5)实验结论: .
【答案】
(1)铜片;锌片;CuSO4溶液
(2)Cu2++2e﹣=Cu;Zn﹣2e﹣=Zn2+
(3)由(1)可知原电池的装置图为 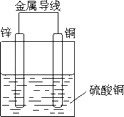
(4)负极不断溶解,正极上有红色固体析出,溶液蓝色变浅
(5)金属活动性Zn>Cu
【解析】解:(1)利用反应Zn+CuSO4=ZnSO4+Cu设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO4 , 所以答案是:铜片;锌片; CuSO4溶液;(2)原电池工作时,正极反应式为Cu2++2e﹣=Cu,负极反应式为Zn﹣2e﹣=Zn2+ , 所以答案是:Cu2++2e﹣=Cu;Zn﹣2e﹣=Zn2+;(3)由(1)可知原电池的装置图为 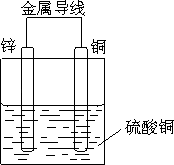 ,所以答案是:
,所以答案是:  ;(4)正极发生还原反应,生成红色金属铜,溶液蓝色变浅.负极发生氧化反应,锌逐渐溶解,所以答案是:负极不断溶解,正极上有红色固体析出,溶液蓝色变浅;(5)锌逐渐溶解,正极析出红色金属铜,说明金属活动性Zn>Cu,所以答案是:金属活动性Zn>Cu.
;(4)正极发生还原反应,生成红色金属铜,溶液蓝色变浅.负极发生氧化反应,锌逐渐溶解,所以答案是:负极不断溶解,正极上有红色固体析出,溶液蓝色变浅;(5)锌逐渐溶解,正极析出红色金属铜,说明金属活动性Zn>Cu,所以答案是:金属活动性Zn>Cu.


科目:高中化学 来源: 题型:
【题目】以乙炔作为原料的合成反应,下列过程中能生成CH2BrCHBrCl的是( )
A.先加HCl,再加HBr B.先加Cl2再加HBr
C.先加HCl,再加Br2 D.先加HBr,再加HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的认识正确的是( )
A. H+和OH-的反应活化能接近于零,反应几乎在瞬间完成
B. 对于任何化学反应来说,化学反应速率越大,反应现象就越明显
C. 化学反应速率的快慢主要是由温度、浓度、压强等外因决定的
D. 选用适当的催化剂,分子运动加快,增加了碰撞频率,故化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键、共价键的叙述中,正确的是
A. 在离子化合物里,只存在离子键,没有共价键
B. 在共价化合物分子内,一定不存在离子键
C. 只含非金属元素的化合物一定是共价化合物,
D. 由多种元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B. 碘晶体受热转变成碘蒸气,破坏了共价键
C. CH3CH2OH和CH3OCH3互为同分异构体
D. 加热氧化镁使之熔化克服的是共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关煤的说法中不正确的是
A.煤是工业上获得芳香烃的重要来源
B.开发新能源,减少燃煤,是控制酸雨,保护环境的有效途径之一
C.煤、石油、水煤气均是可再生能源
D.煤的干馏和石油的裂解过程均属于化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制取和收集某气体的实验装置,该装置可用于( ) 
A.用浓盐酸和二氧化锰反应制取Cl2
B.用浓硝酸与铜反应制取NO2
C.用过氧化钠固体和水反应制取O2
D.用浓氨水和生石灰反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOHb.Zn c.Fe d.NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 摩尔是物质的量的单位
B. 氢的摩尔质量为2g/mol
C. NaOH的摩尔质量是40g
D. 2molH2O的摩尔质量是1molH2O摩尔质量的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com