
| A. | 乙烷属于饱和链烃,乙烯属于不饱和链烃 | |
| B. | 乙烷分子则为立体结构,不是所有原子都在同一平面上,乙烯分子中所有原子都处于同一平面上 | |
| C. | 乙烷分子存在中的碳碳单键,乙烯分子存在中碳碳双键 | |
| D. | 酸性KMnO4溶液能鉴别乙烷和乙烯,而溴水不能鉴别乙烷和乙烯 |
分析 A.依据碳原子形成的化学键分析,乙烯是不饱和烃,乙烷是饱和烃;
B.根据甲烷是正四面体结构分析乙烷结构,乙烯为平面结构来分析各物质的共面原子;
C.烯烃中存在碳碳双键;
D.把气体通入溴水中,乙烯使其褪色,而乙烷不能,现象不同,可鉴别.
解答 解:A.乙烯含有碳碳双键,属于不饱和烃,乙烷属于饱和烃,故A正确;
B.甲烷是正四面体结构,所以乙烷中所有原子不可能在同一平面上;乙烯为平面结构,所有原子都处在同一平面上,故B正确;
C.烯烃中存在碳碳双键,故C正确;
D.把气体通入溴水中,乙烯使其褪色,而乙烷不能,现象不同,可鉴别,故D正确,故选D.
点评 本题考查了烷烃、烯烃性质的分析应用比较,掌握烷烃、烯烃的结构及性质是解题关键,可以根据甲烷的结构判断乙烷的结构特点,题目较简单.


科目:高中化学 来源: 题型:实验题


| 时间 (s) 浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
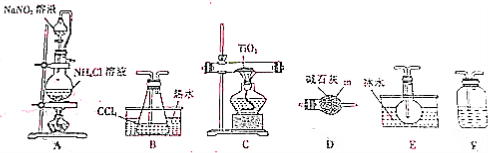
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
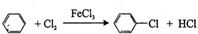
 制取
制取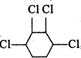 ,即
,即
 ;⑤
;⑤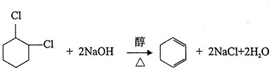 ;⑥
;⑥ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①需要使用普通漏斗 | B. | 步骤②要使用分液漏斗 | ||
| C. | 步骤③要用到坩埚 | D. | 步骤④需要蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
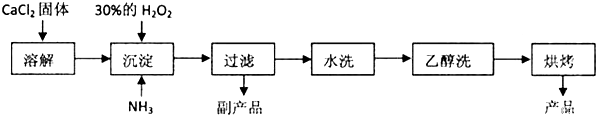
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.
FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com