
在一定温度下的定容密闭容器中发生反应H2(g)+I2(g) 2HI(g),下列方法能说明反应已经达到平衡状态的是( )
2HI(g),下列方法能说明反应已经达到平衡状态的是( )
A.容器内每减少1mol I2,同时生成2mol HI B.容器内气体压强不再变化
C.混合气体的颜色不再变化 D.混合气体的密度恒定不变
科目:高中化学 来源: 题型:
下列关于氢硫酸、亚硫酸、硫酸的说法中正确的是 ( )
A它们都有酸性,电离出的H+有弱氧化性
B它们都是酸,彼此之间不发生反应
C亚硫酸易分解放出SO2,所以它是挥发性酸
D在空气中放置,它们都会因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比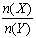 的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为
的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为
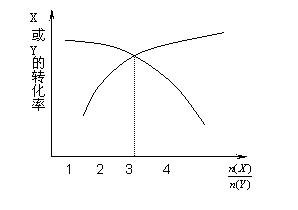
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
A.3X(g)+Y(g) 3Z(g) ΔH<0
3Z(g) ΔH<0
B.X(g)+3Y(g) 4Z(g) ΔH>0
4Z(g) ΔH>0
C.3X(g)+Y(g) 4Z(g) ΔH>0
4Z(g) ΔH>0
D.X(g)+3Y(g) 3Z(g) ΔH<0
3Z(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现

 ①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
A.两个反应都是置换反应 B.据反应条件无法判断反应是否吸热
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,△H能正确表示物质的燃烧热的是 ( )
A.CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B C(s) +1/2O2(g) ==CO(g); △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:重铬酸根离子(Cr2O72—)是橙红色的,铬酸根离子(CrO42-)是黄色的,重铬酸钾溶于水发生反应:
Cr2O72-+H2O  2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量
2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量
6mol/L的硫酸,溶液呈 色,原因是
。
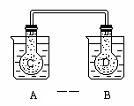 (2)如图所示,在常况下容器 A 中盛有 500mL 蒸馏水,
(2)如图所示,在常况下容器 A 中盛有 500mL 蒸馏水,
在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和
D 中充满二氧化氮气体,并用导管将它们连通。向 A
容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;
向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和 D 中气体的颜色变化是 。
① 不变 ② 烧瓶 C 中颜色变深,D 中变浅
③ 烧瓶D中变深, C中变浅 ④ 两个烧瓶中的颜色都变深
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= 。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施
A.增大N2O4起始浓度 B.向混合气中通入NO2
C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示。则下列说法正确的是:
①反应开始到第一次平衡时,N2的平均反应速率为 0.005mol·L-1·min-1
②从曲线变化可以看出,反应进行到10 min至20 min钟时可能是使用了催化剂
③从曲线变化可以看出,反应进行至25min钟时,分离出0.1mol的氨气
④在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com