
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
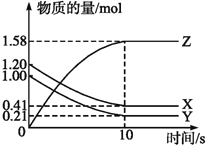
(1)写出该反应的化学方程式__________。
(2)计算反应开始到10 s,用X表示的反应速率是__________,Y的转化率为______。
(3)下列叙述中能说明上述反应达到平衡状态的是____。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是_____________。
(5)为使该反应的反应速率增大,可采取的措施是______.
a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
【答案】 X(g)+Y(g)![]() 2Z(g) 0.0395 mol·(L·s)-1 79.0% B 2v正(Y)=v逆(Z ) bcd
2Z(g) 0.0395 mol·(L·s)-1 79.0% B 2v正(Y)=v逆(Z ) bcd
【解析】试题分析:(1)据曲线图可判断出X、Y为反应物、Z为生成物,且该反应为可逆反应,系数比等于浓度变化量比;
(2)根据速率计算公式计算反应开始到10 s,用X表示的反应速率,Y的转化率=变化量÷起始量。
(3)根据化学平衡定义判断平衡标志。
(4) 当反应达到平衡时,正逆反应速率的比等于系数比。
(5)根据影响反应速率的因素判断.
解析:(1)据曲线图可判断出X、Y为反应物、Z为生成物,且该反应为可逆反应,X、Y的变化量都是0.79mol,z的变化量是1.58mol,系数比等于浓度变化量比,所以反应方程式为X(g)+Y(g)![]() 2Z(g);
2Z(g);
(2)根据速率计算公式,反应开始到10 s,用X表示的反应速率![]() 0.0395 mol·(L·s)-1,Y的转化率=
0.0395 mol·(L·s)-1,Y的转化率=![]() 79.0% 。
79.0% 。
(3)A.当X与Y的反应速率都是指正反应速率,方向相同,不一定平衡,故A错误;
B.根据平衡定义,混合气体中X的质量百分数保持不变,一定平衡,故B正确;
C.根据 ,气体总质量不变、总物质的量不变,混合气体的平均摩尔质量是恒量,平均摩尔质量不随时间的变化而变化,不一定平衡,故C错误;
,气体总质量不变、总物质的量不变,混合气体的平均摩尔质量是恒量,平均摩尔质量不随时间的变化而变化,不一定平衡,故C错误;
D.根据![]() ,气体质量、气体体积都是不变,混合气体的的密度是恒量,混合气体的的密度不随时间的变化而变化,不一定平衡,故D错误;
,气体质量、气体体积都是不变,混合气体的的密度是恒量,混合气体的的密度不随时间的变化而变化,不一定平衡,故D错误;
E.X、Y、Z的浓度之比,不能作为平衡标志,故E错误。
(4) 当反应达到平衡时,正逆反应速率的比等于系数比,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是2v正(Y)=v逆(Z )。
(5)a.恒容时充入Ne,浓度不变,速率不变,故a错误; b.升高温度,速率一定加快,故b正确;c.缩小容器的体积 ,浓度增大,速率加快,故c正确; d.选择高效催化剂,,速率加快,故d正确;


科目:高中化学 来源: 题型:
【题目】由硫酸钾、硫酸铝和硫酸组成的混合溶液,pH=1,c(Al3+)=0.4mol·L-1,c(SO42—)=0.8mol·L-1,则c(K+)为( )
A. 0.4mol·L-1 B. 0.2mol·L-1 C. 0.15mol·L-1 D. 0.3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式__________,____________。
(2)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是_________(填元素符号),第一电离能最大的是_________(填元素符号)。该晶体中的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(4)氨的沸点_________(填“高于”或“低于”)膦(PH2),原因是_____________。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.煤、石油、天然气均为化石燃料,它们属于可再生资源
B.大自然利用太阳能最成功的是植物的光合作用
C.石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油
D.化肥的大量使用不会造成环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象和结论一致,正确的是( )
A.氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在
B.氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在
C.氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl﹣存在
D.氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)下列分离和提纯物质的方法错误的是( )
物质 | 杂志 | 试剂或用品 | 主要操作 | |
A | 淀粉 | 碘化钾 | 半透膜 | 渗析 |
B | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
C | Fe | I2 | / | 加热 |
D | 溴 | 四氧化碳 | 蒸馏装置 | 蒸馏 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列不发生反应的一组物质是( ) ①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与水⑤铁与液氯 ⑥一氧化氮与氧气 ⑦硅与氧气 ⑧H2S与SO2 .
A.①②③⑥
B.②③⑥⑧
C.①④⑤⑦
D.①②③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:

实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷却至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140℃~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是____________________ ,进水口为__________(填“C”或“D”)。
(2)在洗涤操作中,第一次水洗的主要目的是________________; 第二次水洗的主要目的是________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)实验中加入少量无水硫酸镁的目的是_______________________
(5)在蒸馏操作中,仪器选择及安装都正确的是____________________(填标号)

(6)本实验的产率是:_________
A.30℅ B.40℅ C.50℅ D.60℅
(7)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏_______(填“高”或者“低”),原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com