
【题目】室温时,下列溶液混合后,pH大于7的是
A. 0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B. 0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C. pH=3的硫酸和pH=11的氨水等体积混合
D. pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在济液中能大量共存的是
A. Na+、OH-、S2O32-、Cl- B. Fe3+、K+、,AlO2-、HCO3-
C. H+、Al3+、CO32-、SO42- D. H+、Na+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
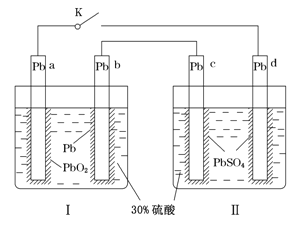
A. 闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. 闭合K时,Ⅱ中SO42—向c电极迁移
D. 闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Fe和Fe2O3 的混合物 15 g,加入150 mL 2 mol/L 的稀硫酸,固体混合物完全溶解,放出气体 1.68 L(标准状况下),向所得溶液中滴入硫氰化钾溶液,未见颜色变化。若要使该溶液中的铁元素完全转化为沉淀,需加入3 mol/L 的NaOH溶液的体积为( )
A. 150 mL B. 200 mL C. 225 mL D. 250 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
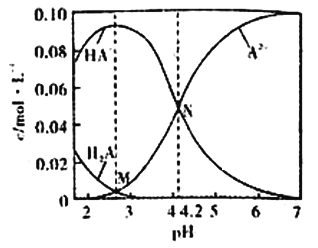
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
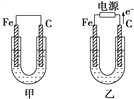
(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:______________________________________
②甲池中碳极上电极反应式是_______________________________________,
乙池中碳极上电极反应属于________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.生石灰、白磷、冰水混合物
B.烧碱、液氧、碘酒
C.干冰、铁、氯化氢
D.纯碱、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com