
(15分)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,HA的电离度为0.10;在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
|
25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA === H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
|
在苯中,2HA == (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1= 。
(2)25℃,该水溶液的pH为 ,在苯体系中HA的转化率为__________。
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足 ,则反应向_______方向进行。
,则反应向_______方向进行。
(4)在苯中,HA自发进行发生二聚:2HA (HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。
(HA)2, 已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是
。

(5)下列有关该混合体系说法不正确的是 。
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小。
B.升高温度,HA的电离平衡常数K1和2HA  (HA)2的平衡常数K2均变大。
(HA)2的平衡常数K2均变大。
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度。
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4。
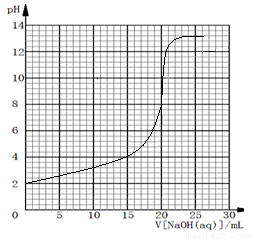
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图。

3.3×10-5 3.5 33% 逆 B ABD
【解析】(1)HA的起始浓度是3.0×10-3 mol·L-1,所以已经电离的是3.0×10-3 mol·L-1×0.1,因此溶液中氢离子浓度是3.0×10-4 mol·L-1,所以pH=4-lg3=3.5
。则平衡常数是 。
。
(2)设转化率是x,则属于HA的浓度是4.0×10-3 mol·L-1×(1-x),由于水中HA的浓度是3.0×10-3 mol·L-1×0.9,所以根据题意可知4.0×10-3 mol·L-1×(1-x)=3.0×10-3 mol·L-1×0.9,解得x=33% 。
(3)根据(2)可知平衡常数为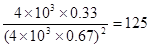 。由于
。由于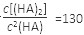 ,所以反应向逆反应方向进行。
,所以反应向逆反应方向进行。
(4)HA自发进行发生二聚,所以是放热反应,又因为二聚反应的反应热数值约为活化能的5/9 ,所以选项B正确。
(5)用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,促进弱酸电离,使体系粒子数增多,苯溶液中加少量苯,促进反应向分子数增多方向移动,平衡向左移动。A不正确;升高温度,促进电离,HA的电离平衡常数K1变大。双聚反应,一般是形成分子间氢键的过程,即正反应放热,所以B正确;中和反应,促进电离,消耗HA,同时因为分配系数恒定,苯中的HA进入水体、二聚体发生平衡移动,最终能使两相中的酸消耗完,所以C不正确;该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;计算,所以D不正确,答案选ABD。
(6)
0.1000mol/L HA水溶液中氢离子的浓度是0.1000mol/L×0.1=0.01mol/L,其pH是2。恰好反应时,消耗氢氧化钠是20.00ml。又因为HA是弱酸,所以终点时溶液显碱性,因此图像为 。
。


科目:高中化学 来源:2012届浙江省绍兴一中高三5月模拟考试理科综合化学试卷(带解析) 题型:填空题
(15分)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,HA的电离度为0.10;在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;已知:lg2=0.3,lg3=0.5 其他信息如下:
| 25℃平衡体系(苯、水、HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA === H++A- | K1 | △H1 | 3.0×10-3 mol·L-1 |
| 在苯中,2HA == (HA)2 | K2 | △H2 | 4.0×10-3 mol·L-1 |
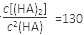 ,则反应向_______方向进行。
,则反应向_______方向进行。 (HA)2,已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是 。
(HA)2,已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是 。
 (HA)2的平衡常数K2均变大。
(HA)2的平衡常数K2均变大。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省常州市高二上学期期末检测化学试卷(解析版) 题型:填空题
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为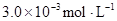 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
|
25℃平衡体系 |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA |
|
|
|
|
在苯中,2HA |
|
|
|
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则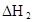 ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期12月月考化学试卷(解析版) 题型:填空题
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为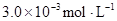 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
|
25℃平衡体系 |
平衡常数 |
焓变 |
起始总浓度 |
|
在水中,HA |
|
|
|
|
在苯中,2HA |
|
|
|
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则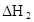 ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足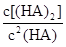 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为![]() 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA |
|
|
|
| 在苯中,2HA |
|
|
|
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA![]() (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则![]() ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足![]() =130,则反应向___________方向进行。
=130,则反应向___________方向进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com