
| A�� | �����ȼ����Ϊ 890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3 kJ•mol-1 | |
| B�� | 500�桢30MPa �£��� 0.5mol N2�� 1.5molH2�����ܱ������г�ַ�Ӧ���� NH3��g�������� 19.3 kJ�����Ȼ�ѧ����ʽΪ��N2+3H2��g��$?_{500�棬30MPa}^{����}$ 2NH3��g����H=-38.6 kJ•mol-1 | |
| C�� | ϡ����� ϡ����������Һ��ϣ����Ȼ�ѧ����ʽΪ��H+��aq��+OH-��aq��=H2O��1����H=-57.3 kJ•mol-1 | |
| D�� | 1molH2��ȫȼ�շ��� 142.9kJ��������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��1����H=+285.8 kJ•mol-1 |
���� A��ȼ������ˮΪҺ�壻
B���ϳɰ�Ϊ���淴Ӧ���Ȼ�ѧ����ʽת��Ϊ��ȫת��ʱ�������仯�����ʱ�Ϊ����
C��ϡ��ǿ����ǿ������1molH2O��1��Ϊ�к��ȣ�
D�����ʵ��������������ȣ���ȼ�շ�Ӧ���ʱ�Ϊ����
��� �⣺A�������ȼ����Ϊ 890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽΪCH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3 kJ•mol-1����A����
B���ϳɰ�Ϊ���淴Ӧ���Ȼ�ѧ����ʽת��Ϊ��ȫת��ʱ�������仯�����ʱ�Ϊ�������Ȼ�ѧ����ʽΪ��N2+3H2��g��$?_{500�棬30MPa}^{����}$ 2NH3��g����H��-38.6 kJ•mol-1����B����
C��ϡ��ǿ����ǿ������1molH2O��1��Ϊ�к��ȣ���ϡ�����ϡ����������Һ��ϣ����Ȼ�ѧ����ʽΪH+��aq��+OH-��aq��=H2O��1����H=-57.3 kJ•mol-1����C��ȷ��
D�����ʵ��������������ȣ���ȼ�շ�Ӧ���ʱ�Ϊ����������ȼ�յ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g��=2H2O��1����H=-285.8 kJ•mol-1����D����
��ѡC��
���� ���⿼�鷴Ӧ�����ʱ䣬Ϊ��Ƶ���㣬���շ�Ӧ�������仯��ȼ�������к��ȣ��ʱ�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע���ʱ����������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3COOH��Һ�ĵ�����������ͬŨ�ȵ�HCl��ҺС | |
| B�� | ��25��ʱ��0.1mol/L��CH3COOH��ҺpHԼΪ3 | |
| C�� | ��25��ʱ��1mol/L��CH3COONa��Һ��pHԼΪ9 | |
| D�� | 0.1molCH3COOH��0.1 mol NaOHǡ���к�����CH3COONa |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ������ | ������ |
| A | Si�е����� | Si�������Ʊ����ά |
| B | Fe�Ľ�����Դ���Cu | FeCl3��Һ�����ڻ��շϾɵ�·���е�ͭ |
| C | Na2O2��ˮ��Ӧ�����ɼ� | Na2O2���ڼ��������� |
| D | ����������ֽ� | ������ˮ��������ɫ�Լ�ƿ�У������䰵�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K��HF��=c��F-��?c��H+��/c��HF �� | B�� | K��HNO2��=7.2��10-4 | ||
| C�� | ����ǿ��Ϊ HF��HNO2 | D�� | K��HNO2����K��HF�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
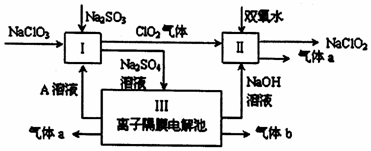
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢܢ� | B�� | ֻ�Т٢� | C�� | ֻ�Тڢ� | D�� | ֻ�Тۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ��Ũ�ȣ�������λ����ڻ���ӵİٷ������Ӷ�������Ч��ײ�Ĵ��� | |
| B�� | ������μӵĻ�ѧ��Ӧ��������ѹǿ������С��Ӧ������������������ӻ���ӵİٷ������Ӷ�ʹ��Ӧ�������� | |
| C�� | �����¶���ʹ��ѧ��Ӧ����������Ҫԭ���������˷�Ӧ������л���ӵİٷ��� | |
| D�� | ������Ӱ�췴Ӧ��ܵ�������λ����ڻ���ӵİٷ������Ӷ�����Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �ҹ��涨�����ڼ�ȩ�������ó���0.08mg•m-3��ij�о���ѧϰС������������KMnO4��Һ�ⶨ�����м�ȩ�ĺ���������Э������������ѧϰ��������װ����ͼ�����䷴Ӧԭ�����������£�
�ҹ��涨�����ڼ�ȩ�������ó���0.08mg•m-3��ij�о���ѧϰС������������KMnO4��Һ�ⶨ�����м�ȩ�ĺ���������Э������������ѧϰ��������װ����ͼ�����䷴Ӧԭ�����������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
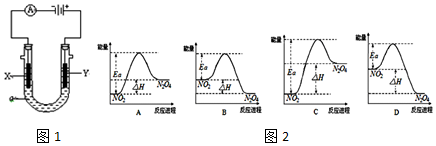
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com