
在周期表中,下列递变规律正确的是( )
A.随着碱金属原子半径的增大,其最高价氧化物对应的水合物,碱性逐渐减弱
B.随着卤素原子半径的增大,其氢化物稳定性逐渐减弱
C.着卤素原子半径的增大,其单质的氧化性逐渐增加
D.随着卤素原子半径的增大,其最高价氧化物对应的水合物,其酸性逐渐增强
科目:高中化学 来源: 题型:


| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
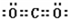
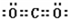
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
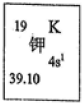 我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com