
| A. | 用加热法分离泥沙中的碘单质 | B. | 干冰气化 | ||
| C. | 电解水 | D. | 用蒸馏法制取蒸馏水 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气用于自来水消毒-次氯酸的强氧化性 | |
| B. | 碘化银用于人工降雨-使空气中水蒸汽凝聚 | |
| C. | 氢氟酸腐蚀玻璃-强酸性 | |
| D. | 过氧化钠用于做供氧剂-能与CO2、H2O反应生成氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

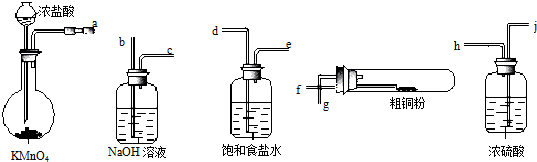
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
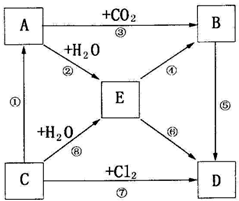
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
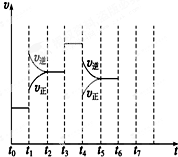 在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
在一密闭容器中发生反应N2+3H22NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com