
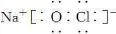
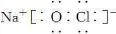


科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
查看答案和解析>>
科目:高中化学 来源: 题型:

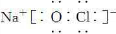
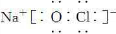
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省大庆实验中学高三上学期开学考试化学试卷(带解析) 题型:填空题
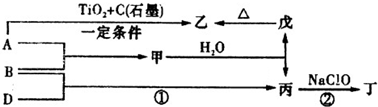
(11 分)已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。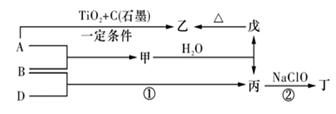
请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
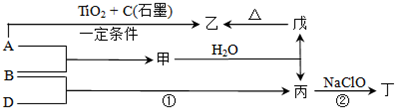
(11 分)已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。

请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com