
A、B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数.①若A为ⅡA族,其质量数为X,则B的质子数为Y;②若A为ⅣA族,其质子数为m,则B质量数为n,则Y和n的值是
A. (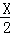 +18)和(2m+18) B. (
+18)和(2m+18) B. (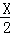 +8)和(2m+18)
+8)和(2m+18)
C. (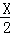 +8)和(2m+36) D. (
+8)和(2m+36) D. (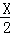 +18)和(2m+36)
+18)和(2m+36)
科目:高中化学 来源:2015-2016学年福建省高一下期末化学试卷(解析版) 题型:选择题
化学与生活密切相关。下列有关说法错误的是
A.用灼烧的方法可以区分蚕丝和人造纤维
B.医用消毒酒精中乙醇的浓度为75%
C.加热能杀死流感病毒是因为蛋白质受热变性
D.糖类、油脂和蛋白质均为高分子化合物,均可发生水解反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:实验题
I.为了探究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂进行了如下实验,请填写下列空白:
试剂:5%H2O2溶液,10%H2O2溶液,1mol/LFeCl3溶液,MnO2粉末
仪器:试管、胶头滴管、酒精灯
(1)实验目的:探究温度对化学反应速率的影响
实验步骤:分别对A、B两支试管中加入5mL 5%H2O2溶液,将试管A放入5℃水浴中,将试管B放入40℃水浴中,同时分别向两试管中加入2~3滴1mol/LFeCl3溶液。观察实验现象。
实验现象:试管________(填“A”或“B”)中产生气泡的速率快,说明___________。
(2)实验目的:探究浓度对化学反应速率的影响
实验步骤:向试管A中加入5mL 5%H2O2溶液,向试管B中加入5mL 10%H2O2溶液,观察实验现象。
实验现象:试管A、B中均有少量气体缓慢产生。
请你改进实验方案,使该实验的实验现象更为明显,以支撑“浓度改变会影响化学反应速率”这一理论预测,___________________________。
(3)实验目的:________________________。
实验步骤:分别向试管A和B中加入5mL 5%H2O2溶液后,再向试管B中加入1mL 1mol/L的FeCl3溶液,观察实验现象。
你认为方案(3)的设计是否严谨?_________(填是或否),说明理由_________________。
II.请设计“以镁与不同浓度稀硫酸反应探究浓度对化学反应速率影响”的实验方案。
实验中可供选择的试剂与用品:镁带(密度1.74g/cm、宽度0.5cm、厚度0.05cm)、砂纸、剪刀、1.0mol/L的硫酸、蒸馏水、恒温水浴箱、试管、量筒、秒表。实验方案:_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:简答题
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的5倍,G的3d轨道有3个未成对电子,请回答下列问题:
(1)F的基态原子电子排布式为 ,G在周期表的位置 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答),A、C、D形成的离子化合物中的化学键类型 。
(3)下列关于B2A2(B原子最外层满足8电子稳定结构)分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)用电子式表示E的氯化物的形成过程 。
(5)F的最高正价为+6价,而氧原子最多只能形成2个共价键,试推测CrO5的结构式________。
(6)C的最低价的氢化物为CH3,通常情况下,G2+的溶液很稳定,它与CH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[G(CH3)6]3+,该反应的离子方程式是 ,1 mol [G(CH3)6]3+配离子含有σ键数目为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是
A.Y和W的含氧酸均为强酸
B.YW3分子中Y原子的杂化方式为sp2,分子的空间构型为平面三角形
C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
下列有关叙述正确的是
A. 元素性质呈周期性变化的根本原因是元素化合价呈周期性变化
B. BF3和CO2分子中所有原子均满足最外层为8电子结构
C. 已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298
D. [14NH3T]+中,电子数、质子数、中子数之比为10:11:9
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期末化学试卷(解析版) 题型:选择题
甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是
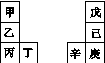
A. 金属性:甲>乙>丁
B. 原子半径:辛>戊>己
C. 丙与庚的原子核外电子数相差13
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:简答题
【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g) SO3(g) ;ΔH=-98 kJ · mol-1。开
SO3(g) ;ΔH=-98 kJ · mol-1。开 始时在100 L的密闭容器中加入4.0 mol
始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。

(4)下列关于2SO2(g)+O2(g) 2SO3(g)反应的图像中,
2SO3(g)反应的图像中, 一定正确的是________(填序号)。
一定正确的是________(填序号)。

(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com