
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是
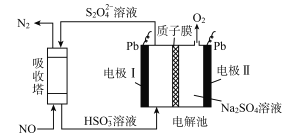
A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D. 每处理1 mol NO电解池质量减少16g
【答案】C
【解析】A. 电极I为阴极,阴极上是HSO3-获得电子生成S2O42-,酸性条件下还生成水,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,故A错误;B. 电解池中质子从电极Ⅱ向电极I作定向移动,故B错误;C. 吸收池中S2O42-与NO反应生成N2与HSO3-,反应离子方程式为:吸收塔中的反应为2NO+ 2S2O32-+H2O=N2+4HSO3-,故C正确;D、电解池中发生的反应:4HSO3-=2H2O+O2+2S2O42-,结合吸收塔中的反应:2NO+ 2S2O32-+H2O=N2+4HSO3-,得关系式:2NO~O2~4H+,每处理1 mol NO电解池质量减少16 gO2和2gH+,共18g,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是 ( )
A.加入Al生成H2的溶液:CO32-、NH4+、Cl-、K+
B.酸性溶液中:K+、Na+、SiO32-、Cl-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.硫酸钠的溶液中:Mg2+、NO3-、K+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
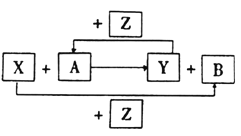
【题目】X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
(1)X、Y均为金属时,此反应在工业上称为___反应,其反应方程式为________
(2)X为金属,Y为非金属时,A为__B__
(3)X为非金属Y为金属时,A为__B为_______
(4)X为非金属,Y为非金属时,A为_____B为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____I-+____IO3—+____H+ =____I2+____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______,上述操作正确的顺序是:_______(填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所消耗的KI的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某稀硫酸和稀硝酸的混合溶液200 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。
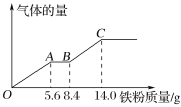
下列分析或结果正确的是( )
A. 原混合溶液中NO3 -的物质的量为0.3 mol
B. OA段产生的是NO
C. BC段产生NO
D. 原混合溶液中H2SO4的浓度为1.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是
的物质的量随时间变化的曲线如图所示。下列判断正确的是
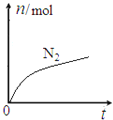
A. 该反应的氧化剂ClO-,还原产物是![]() B. 消耗1mol还原剂,转移6mol电子
B. 消耗1mol还原剂,转移6mol电子
C. 水是生成物,且反应后溶液的酸性明显增强 D. 氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 某溶液中加入盐酸酸化的 | 白色沉淀 | 溶液中一定含有 |
B | 用激光笔照射鸡蛋白溶液 | 有丁达尔效应 | 鸡蛋白溶液属于胶体 |
C | 某气体通入酸性 | 紫色褪去 | 该气体一定是 |
D | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空)。
(2)DA2分子的VSEPR模型是___________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。
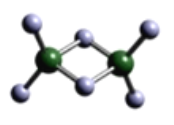
②[C(OH)4]-中存在的化学键有________。
(4)B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
(5)D与E形成化合物晶体的晶胞如下图所示:
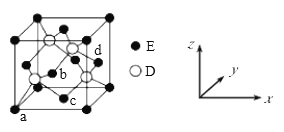
①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.所含质子数和电子数相等的粒子一定是原子
B.具有相同核电荷数的原子或简单的离子,一定是同种元素
C.质量数相同的原子其化学性质一定相同
D.两种粒子如果核外电子排布相同,化学性质就一定相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com