
| A.HBr | B.NaHSO4 | C.NH4NO3 | D.NaHCO3 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.Al3+、Na+、NO3-、Cl- | B.Cu2+、Na+、NO3-、Cl- |
| C.Ba2+、K+、CO32-、MnO4- | D.NH4+、H+、CH3COO-、 OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 离子或分子 | 要求 |
| A | Na+、HCO、Mg2+、SO | 滴加氨水立即有沉淀产生 |
| B | Fe3+、NO、SO、Cl- | 滴加盐酸立即有气体产生 |
| C | NH、Al3+、SO、CH3COOH | 滴加NaOH溶液立即有气体产生[ |
| D | K+、NO、Cl-、HS- | c(K+)<c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两溶液混合反应后的所得的混合溶液呈碱性 |
| B.所用酸溶液的浓度大于所用氢氧化钠溶液的浓度 |
| C.若酸为醋酸,原醋酸溶液中有1%的醋酸已电离 |
| D.若酸为醋酸,反应后的溶液中CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
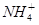 ,Fe3+,Ba2+,
,Fe3+,Ba2+,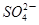 ,Cl-,S2-,为检验其成分,先对溶液进行初步分析.下列判断不正确的是
,Cl-,S2-,为检验其成分,先对溶液进行初步分析.下列判断不正确的是| A.溶液中存在大量Fe3+ | B.溶液中可能存在大量Ba2+ |
| C.溶液中不存在S2- | D.溶液可能呈强碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
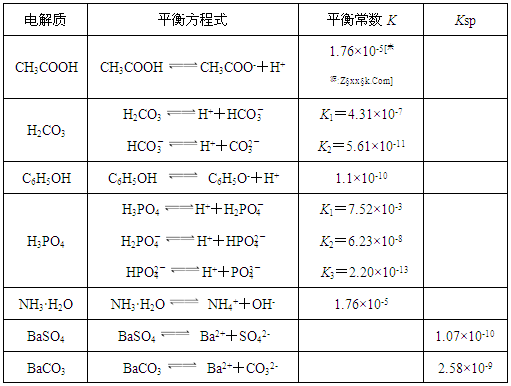
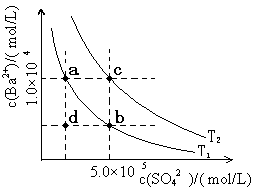
 1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq)
1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理 次。[提示: BaSO4(s)+ CO32- (aq) BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.无色溶液中:K+、H+、NO3-、[A1(0H)4]- |
| B.能与铝片反应产生氧气的溶液中:Al3+、Cl-、Fe2+、NO3- |
| C.在由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| D.含有较多Fe3+的溶液中:Na+、S042-、SCN-、I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
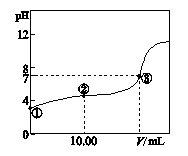
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com