
【题目】下列解释事实的方程式不正确的是( )
A.将装有NO2的玻璃球浸入热水中颜色加深:2NO2(g)![]() N2O4(g) ΔH>0
N2O4(g) ΔH>0
B.用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
C.Na2S2O3溶液与稀H2SO4混合产生浑浊:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
D.闪锌矿(ZnS)经CuSO4溶液作用转变为铜蓝(CuS):ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)
【答案】A
【解析】
A.装有NO2的玻璃球浸入热水中颜色加深,说明NO2的浓度增大,反应2NO2(g)![]() N2O4(g)的平衡逆向移动;说明升高温度,平衡逆向移动,逆反应是吸热反应,正反应是放热反应,△H<0,A错误,符合题意;
N2O4(g)的平衡逆向移动;说明升高温度,平衡逆向移动,逆反应是吸热反应,正反应是放热反应,△H<0,A错误,符合题意;
B.利用Na2S处理含有Hg2+废水,由于HgS难溶于水,离子方程式为Hg2++S2-=HgS↓,B正确,不选;
C.Na2S2O3和酸反应可生成S和SO2,化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,C正确,不选;
D.CuS比ZnS难溶,因此闪锌矿(ZnS)经CuSO4溶液作用后,ZnS可以转化为更难溶的CuS,离子方程式为ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq),D正确,不选;
答案选A。


科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A |
| Zn保护了Fe不被腐蚀 |
B |
| 2NO2(g)N2O4(g)为吸热反应 |
C |
| 木炭与浓硝酸发生了反应 |
D |
| 碳酸钠的水解程度强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
A.![]() 与
与![]() 组成的混合物中,含有的电子数目为
组成的混合物中,含有的电子数目为![]()
B.![]() (标准状况)
(标准状况)![]() 与足量乙烷反应时,断裂的
与足量乙烷反应时,断裂的![]() 键数目为
键数目为![]()
C.![]() 浓度均为
浓度均为![]() 的
的![]() 、
、![]() 溶液中,
溶液中,![]() 数目前者比后者多
数目前者比后者多![]()
D.![]() [电离方程式:
[电离方程式:![]() ]消耗
]消耗![]() 数目最多为
数目最多为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )

A.T1>T2
B.b点时二聚体的浓度为0.45mol·L-1
C.a点的正反应速率小于b点的逆反应速率
D.a点的反应速率小于c点的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
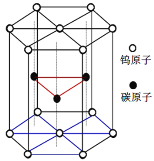
【题目】碳化钨(WC)是大型飞机发动机关键部位材料。
(1)基态钨原子的外围电子排布式为5d46s2,有___个未成对电子。
(2)在第二周期的非金属主族元素中,第一电离能由大到小顺序为___。
(3)硫氰化钾(KSCN)俗称玫瑰红酸钾,是铁离子的检验指示剂。
①SCN-中,中心原子碳的杂化类型是___,该离子的空间构型是___。
②SCN-的等电子体分子是___(任写一个)。
(4)C3H8和纯叠氮酸(HN3)的相对分子质量相近,但C3H8常温下是气态,而纯叠氮酸常温下是一种液体,沸点为308.8K,主要原因是___。
(5)NH3的键角是107°,NF3的键角是102.5°。NF3的键角比NH3的键角小,原因是___。
(6)碳化钨晶胞如图所示。①一个W原子与周围___个碳原子紧密相邻且等距。WC的熔点为2870℃,沸点是3000℃,硬度非常大,它的晶体类型是___。
②已知该晶胞边长为acm,高为hcm,NA为阿伏伽德罗常数。WC的摩尔质量为Mg·mol-1。该晶体密度为___g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是( )
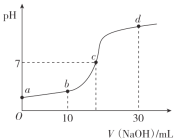
A.a点:pH=1
B.c点:V(NaOH)=20mL
C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.a→d过程中,水电离出c(H+)不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能准确表达其变化的是
A.钠在空气中变暗:2Na+O2 =Na2O2
B.蔗糖加浓硫酸变黑:C12H22O11![]() 12C+11H2O
12C+11H2O
C.漂白粉久置失效:Ca(ClO)2+CO2+H2O=CaCO3+ 2HC1O 2HC1O=2HCl+O2
D.SO2形成酸雨:2SO2+O2+2H2O=2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.标准状况下,3.36L的氦气中含有0.6NA个中子
B.6.5gZn与足量浓H2SO4完全反应,产生气体的分子数为0.1NA
C.标准状况下,2.24L的乙酸在O2中完全燃烧,得到0.2NA个CO2分子
D.1molFe与足量稀硝酸充分反应后,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.2.1g丙烯中所含的共用电子对总数为0.3NA
B.在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
C.过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D.5.6 g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com