
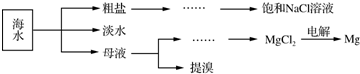
分析 (1)海水淡化水,应将水与盐分离,可用蒸馏、电渗析或离子交换法等,以此解答;氯化钡除去SO42-离子,粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以出去溶液中多余的钡离子;过滤后加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(2)用无水MgCl2制取Mg,电解熔融状态的氯化镁可以得到镁和氯气;
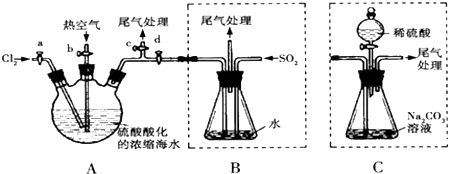
(3)①氯气为黄绿色气体,反应完毕应剩余氯气;
②溴单质溶于水,加硫酸是为了抑制溴单质与水的反应;溴易挥发;
③步骤Ⅰ制取溴,步骤Ⅱ使溴挥发,步骤Ⅲ吸收溴成溴离子,步骤Ⅳ生成溴;
④溴、氯气和二氧化硫都有毒,可用碱液吸收;
(4)根据题给信息,溴离子与溴酸根离子在酸性条件下发生氧化还原反应生成溴单质,据此写出反应方程式.
解答 解:(1)氯化钡除去SO42-离子,粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以出去溶液中多余的钡离子,需要依次加入稍过量的NaOH、BaCl2 、Na2CO3,过滤后,在滤液中加入盐酸至不再有气体生成;故答案为:BaCl2;Na2CO3;
(2)金属镁属于活泼金属,无水氯化镁在熔融状态下,通过电解MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑得到金属镁,故答案为:电解法;
(3)①氯气为黄绿色气体,反应完毕应剩余氯气,故答案为:A中液面上方出现黄绿色气体;
②溴单质溶于水,加硫酸是为了抑制溴单质与水的反应;溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:酸化可抑制溴单质与水的反应;使A中生成的Br2随空气流进入B中;
③步骤Ⅰ制取溴,步骤Ⅱ使溴挥发,步骤Ⅲ吸收溴成溴离子,步骤Ⅳ生成溴,故这四步操作的最终目的为富集溴,故答案为:富集溴;
④氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以用碱液吸收,故答案为:c;
(4)根据题给信息,溴离子与溴酸根离子在酸性条件下发生氧化还原反应生成溴单质,据此写出反应方程式为:5Br-+BrO3-+6H+=3 Br2+3H2O,故答案为:5Br-+BrO3-+6H+=3 Br2+3H2O.
点评 本题考查较综合,涉及粗盐提纯、氧化还原反应、海水提取溴的过程、实验基本操作、实验方案的评价等,为高考常见题型,掌握实验的原理和操作方法结合流程图信息是解答本题的关键,注意氧化还原反应的强弱规律应用,归中反应的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 过量浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.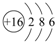 ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)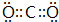 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: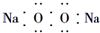 | |
| B. | 碳正离子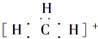 中质子数与电子数的比值为3:2 中质子数与电子数的比值为3:2 | |
| C. | 硫离子的结构示意图: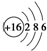 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第二周期元素的最高化合价为+1→+7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com