
【题目】下列指定反应的离子方程式正确的是( )
A.用FeCl3溶液腐蚀铜板:Fe3++Cu═Fe2++Cu2+
B.向氨水中通入过量SO2:SO2+2NH3?H2O═2NH4++SO32﹣+H2O
C.用MnO2与浓盐酸反应制Cl2:MnO2+4HCl ![]() ?Mn2++2Cl﹣+Cl2↑+2H2O
?Mn2++2Cl﹣+Cl2↑+2H2O
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3+4OH﹣═2FeO43﹣+3Cl﹣+5H2O
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为 , 其中氮的化合价为
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式为_.
(3)①2O2(g)+N2(g)=N2O4(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4
上述反应热效应之间的关系式为△H4=(用△H1、△H2、△H3表示).
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+ K=8.5×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
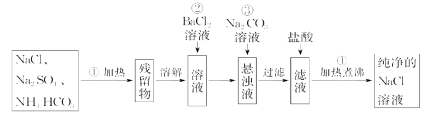
如果此方案正确,那么:
(1)进行操作①可选择的最常用仪器是______________。
(2)操作②为什么不用硝酸钡溶液,其理由是_____________________________。
(3)进行操作②后,如何判断![]() 已除尽,方法是_________________________。
已除尽,方法是_________________________。
(4)操作③的目的是________________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作④的目的是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的酸性溶液中,能共存的离子组是( )
A.NH4+、Cl﹣、Fe2+、K+B.Na+、CO32﹣、K+、Cl﹣
C.Cl﹣、Ba2+、Na+、SO42﹣D.K+、SO42﹣、OH﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 。
(3)A的氢化物属于 (填“极性”或“非极性”)分子,D的低价氧化物分子的立体构型是 。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为 (每个球均表示1个原子)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A.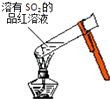 加热后溶液颜色变为无色
加热后溶液颜色变为无色
B.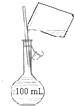 配制100 mL 0.10 molL﹣1NaCl溶液
配制100 mL 0.10 molL﹣1NaCl溶液
C.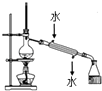 实验室用该装置制取少量蒸馏水
实验室用该装置制取少量蒸馏水
D.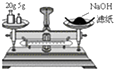 称量25 g NaOH
称量25 g NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4水溶液中H2C2O4、HC2O4﹣和C2O42﹣三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( ) 
A.曲线①代表的粒子是HC2O4﹣
B.0.1molL﹣1NaHC2O4溶液中:c(C2O42﹣)>c(H2C2O4)
C.pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42﹣)>c(H2C2O4)>c(HC2O4﹣)
D.在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42﹣)将减小,c(Ca2+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500molL﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000molL﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( ) 
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣)
B.点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣)
D.滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com