
现有甲、乙两个实验,进行反应N2(g)+3H2(g)?2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)?2HI(g)△H=-akJ?mol-1,实验条件和起始投料如下表所示,以下结论正确的是( )
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2xmol |
| 2 |


科目:高中化学 来源: 题型:阅读理解
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
| ||
| ||
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源:中学教材全解 高中化学必修2(配山东科学技术出版社实验教科书) 山东科学技术出版社实验教科书 题型:043
为了测定一种气态烃A的化学式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气.现有甲、乙两个方案来求A的最简式.测得的有关数据如下(箭头表示气流的方向,实验前系统内的空气已排净):
甲:![]()
乙:![]()
试回答:(1)你认为哪种方案能求出A的最简式,简述理由.
(2)请根据你选择的方案,通过计算求出A的最简式.
(3)若要确定A的分子式,是否需要测定其他数据?说明其原因
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三10月月考化学试卷(解析版) 题型:选择题
现有甲、乙两个实验,进行反应N2(g)+3H2(g)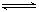 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g) 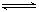 2HI(g) ∆H=-akJ•mol—1,实验条件和起始投料如下表所示,以下结论正确的是
2HI(g) ∆H=-akJ•mol—1,实验条件和起始投料如下表所示,以下结论正确的是
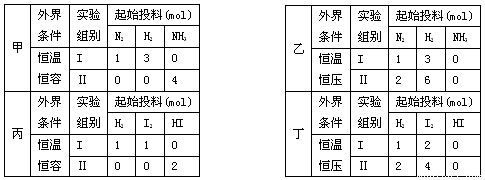
A.甲组中,若平衡时N2和NN3的转化率分别为α1 和α2,则α1 +α2=1
B.乙组中,平衡Ⅱ中NH3的浓度是平衡Ⅰ的二倍
C.丙组中,若达平衡时Ⅰ中放热Q1kJ, Ⅱ中吸热Q2kJ,则Q1+Q2=a
D.丁组中,达平衡所需时间:Ⅰ小于Ⅱ
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省哈三中高三10月月考化学试卷(带解析) 题型:单选题
现有甲、乙两个实验,进行反应N2(g)+3H2(g) 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)  2HI(g) ?H=-akJ?mol—1,实验条件和起始投料如下表所示,以下结论正确的是
2HI(g) ?H=-akJ?mol—1,实验条件和起始投料如下表所示,以下结论正确的是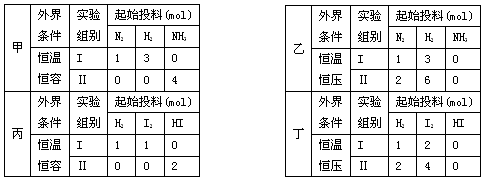
| A.甲组中,若平衡时N2和NN3的转化率分别为α1 和α2,则α1 +α2=1 |
| B.乙组中,平衡Ⅱ中NH3的浓度是平衡Ⅰ的二倍 |
| C.丙组中,若达平衡时Ⅰ中放热Q1kJ, Ⅱ中吸热Q2kJ,则Q1+Q2=a |
| D.丁组中,达平衡所需时间:Ⅰ小于Ⅱ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com