
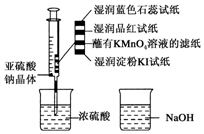
 二氧化硫能起漂白、保鲜作用,使物品颜色显得白亮、鲜艳.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).下列有关说法正确的是( )
二氧化硫能起漂白、保鲜作用,使物品颜色显得白亮、鲜艳.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).下列有关说法正确的是( )| A. | 蓝色石蕊试纸变红后褪色 | |
| B. | NaOH溶液可用于除去实验中多余的SO2 | |
| C. | 湿润淀粉KI试纸未变蓝,说明SO2有还原性 | |
| D. | 品红试纸、蘸有KMnO4溶液的滤纸均褪色,证明了SO2的漂白性 |
分析 A.SO2只能使酸碱指示剂变色;
B.SO2为酸性气体,可与NaOH溶液反应生成盐和水.
C.根据氧化剂+还原剂→氧化产物+还原产物,氧化性:氧化剂>还原剂分析;
D.SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应.
解答 解:A.SO2只能使酸碱指示剂变色,不能漂白,则湿润的蓝色石蕊试纸只变红,故A错误;
B.SO2为酸性气体,有毒,可与NaOH溶液反应生成盐和水,所以NaOH溶液可用于除去实验中多余的SO2,故B正确;
C.湿润淀粉KI试纸未变蓝,说明SO2不能将KI氧化为I2,则SO2的氧化性弱于I2,故C错误;
D.SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应,表现出SO2的还原性,而不是漂白性,故D错误.
故选B.
点评 本题考查二氧化硫的制备和性质,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 16x kJ•mol-1 | B. | 8x kJ•mol-1 | C. | 4x kJ•mol-1 | D. | 2x kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的蓝色石蕊试纸检验NH3 | |
| B. | 用托盘天平称取25.20g NaCl固体 | |
| C. | 用干燥的淀粉碘化钾试纸检验溶液中是否含有Fe3+ | |
| D. | 用25mL碱式滴定管量取14.80mL 1mol•L-1 KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=6的硫酸铝溶液中,由水电离出的c(OH-)=10-6mol/L | |
| B. | 浓度为0.1mol•L-1的NaHCO3溶液:c(H2CO3)>c(CO32-) | |
| C. | 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 | |
| D. | 向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以苯为萃取剂萃取溴水中的溴,分液时应从下口放出苯溶液 | |
| B. | 蒸馏过程时,加热一段时间后,忘加沸石,应停止加热立刻补加 | |
| C. | 分离I2和铁粉的混合物,可加热,利用I2易升华的特性分离 | |
| D. | 配置1mol/L的盐酸,定容后摇匀,液面下降,不影响准确性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素不能互称同分异构体 | |
| B. | 油脂在碱性条件下的水解反应成为皂化反应 | |
| C. | 向鸡蛋清溶液中加入NaCl(s)时,因蛋白质变性致溶液变浑浊 | |
| D. | 使用酸性K2Cr2O7检验酒驾的过程中,乙醇表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
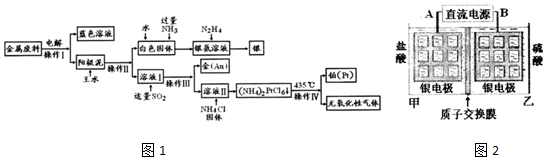
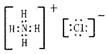 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com