
【题目】下列反应中,能证明SiO2是酸性氧化物的是( )
A.SiO2+2C═Si+2CO↑
B.SiO2+2NaOH═Na2SiO3+H2O
C.SiO2+4HF═SiF4↑+2H2O
D.SiO2+CaCO3═CaSiO3+CO2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________;
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )__________________ ;
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________ , 还可选用_____________________(写试剂的化学式)来提取碘,该步骤所用主要玻璃仪器的名称是__________________________。
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2,实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空:
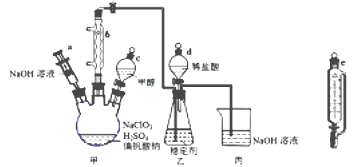
(1)仪器b的名称为________,其作用是_____________。
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式____________________。
(3)甲装置中采取的加热方式是________________,如果滴加甲醇的速度过快,可造成的后果____________。
(4)某同学建议将上述装置中的分液漏斗c改为恒压漏斗,你认为他的理由是______________________。
(5)实验结束后,先用仪器a 注入一定量的NaOH溶液,过一段时后再拆卸仪器,其目的是____________。
(6)下表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是_______( 填"1”或“2”),原因是________________________________。
时间/天 稳定剂 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
稳定剂1 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
稳定剂2 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
(7)某同学在实验室测定某保鲜剂中ClO2含量,其实验操作如下,在维形瓶中加入足量的KI溶液。再加入5mL稀硫酸,取15ml保鲜剂于锥形瓶中。ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+==2C1-+5I2+4H2O;用0.1000 mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62-) 。达到滴定终点时用去18.00mlNa2S2O3标准溶液,测得该保鲜剂中ClO2的含量为________g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体。等电子体之间结构相似,物理性质也相近。以下各组粒子能互称为等电子体的是( )
A. O3和SO2 B. CO和N2 C. CO和NO D. N2H4 和C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(一)利用下列装置制备NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。
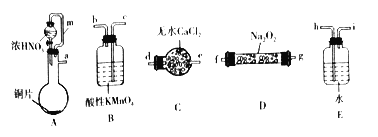
(1)选择上述仪器完成实验,其连按顺序为_______________(按气流方向,用小写字母表示)。
(2)装置A中m管的作用为_________________。
(3)装置B中发生反应的离子方程式为____________________________________________________。
(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。
称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
第一次 | 第二次 | 第三次 | |
酸性高锰酸钾溶液休积/mL | 19.98 | 19.75 | 20.02 |
(4)盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为__________________________。
(5)滴定到终点的实验现象为_________________________________________________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2 的质量分数为_____________(用含a、b的关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________,“沉渣2”的主要成分是____________,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________。
(4)“操作X”是__________、__________,煅烧时产生两种气体的成分是________。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1 molL-1 t溶液与0.1 molL-1 u溶液的pH 均为1。下列说法不正确的是

A. Y、W的最高价氧化物对应的水化物均为强酸
B. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D. v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法,正确的是
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤气态双原子分子中肯定存在着![]() 键,可能存在着π键
键,可能存在着π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形
A.②③⑤ B.②⑥ C.③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com