
| A. | 10% | B. | 18% | C. | 20% | D. | 40% |
分析 由反应$\frac{1}{2}$H2(g)$+\frac{1}{2}$X2(g)?HX(g)的平衡常数为9,可知HX(g)?$\frac{1}{2}$H2(g)$+\frac{1}{2}$X2(g)的平衡常数为$\frac{1}{9}$,设分解的HX为xmol/L,则
HX(g)?$\frac{1}{2}$H2(g)$+\frac{1}{2}$X2(g)
开始 1 0 0
转化 x 0.5x 0.5x
平衡 1-x 0.5x 0.5x
结合K及分解率=$\frac{转化的量}{开始的量}$计算.
解答 解:由反应$\frac{1}{2}$H2(g)$+\frac{1}{2}$X2(g)?HX(g)的平衡常数为9,可知HX(g)?$\frac{1}{2}$H2(g)$+\frac{1}{2}$X2(g)的平衡常数为$\frac{1}{9}$,
设分解的HX为xmol/L,则
HX(g)?$\frac{1}{2}$H2(g)$+\frac{1}{2}$X2(g)
开始 1 0 0
转化 x 0.5x 0.5x
平衡 1-x 0.5x 0.5x
$\frac{(0.5x)^{\frac{1}{2}}(0.5x)^{\frac{1}{2}}}{1-x}$=$\frac{1}{9}$,
解得x=0.18mol/L,
则在该温度时HX(g)的最大分解率接近于$\frac{0.18mol/L}{1mol/L}$×100%=18%,
故选B.
点评 本题考查化学平衡常数的含义及化学平衡的计算,为高频考点,把握化学平衡正逆反应中平衡常数的关系为解答的关键,侧重分析与计算能力的考查,注意化学平衡三段法计算格式,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol•L-lNH3•H2O滴定 10.00mL浓度均为 0.100mol•L-l HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A. | ①点溶液中c (H+)为0.200 mol•L-l | |
| B. | 若反应容器与外界没有热交换,反应后溶液温度高低为①>③>② | |
| C. | pH的大小为:③>②>①,且③点溶液中有c(Cl-)>c(CH3COO-) | |
| D. | ③点后因离子数目减少使溶液电导率略降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、SO42-、CO32- | B. | K+、Ca2+、HCO3-、Cl- | ||
| C. | K+、Al3+、SO42-、NO3- | D. | K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在2L的密闭容器中,高温下发生下列反应:
在2L的密闭容器中,高温下发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
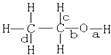
| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和浓硫酸共热至170℃时键b和d断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和氢溴酸反应键a断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
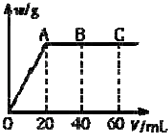 有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).
有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com