
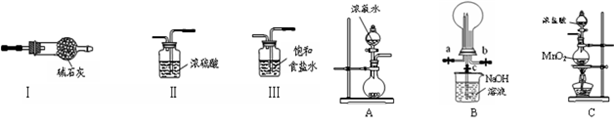
分析 (1)装置A为固液不加热的气体发生装置;锌和硫酸反应生成硫酸锌和氢气;
(2)氨气为碱性气体,应选择碱性干燥剂;生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出;
(3)依据氯化氢、水加热易挥发,氯化氢易溶于水,浓硫酸具有吸水性解答;
(4)氯气与氨气的反应生成氯化铵;根据铵盐与碱共热产生氨气来检验.
解答 解:(1)用装置A制备的气体,反应物状态为固体和液体不加热,锌与稀硫酸在常温下能够反应生成氢气和硫酸锌,可以用A制备,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
故答案为:H2;Zn+H2SO4=ZnSO4+H2↑;
(2)碱石灰为碱性干燥剂,常用来干燥氨气,生石灰与水反应生成氢氧化钙,放出大量的热,有利于氨气的逸出,碱石灰是由生石灰和氢氧化钠组成的混合物,同样可用于与浓氨水制氨气,故答案为:I;ad;
(3)二氧化锰与浓盐酸加热生成氯气,因为氯化氢、水加热易挥发,生成的氯气中含有氯化氢和水杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以通过盛有饱和食盐水的洗气瓶能够出去杂质氯化氢,然后通过盛有浓硫酸的洗气瓶出去水蒸气;
故答案为:水;氯化氢;Ⅲ、Ⅱ;
(4)氯气与氨气的反应方程式为:3Cl2+8NH3=N2+6NH4Cl,则白烟的成分为氯化铵;铵根离子可一碱反应生成碱性气体氨气,铵根离子的检验方法是,取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+,
故答案为:NH4Cl;取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+.
点评 本题综合考查物质的性质、制备实验,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质,结合反应的原理解答该题,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | F- | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 电解Na2SO4饱和溶液,若生成2 NA个H2,一定生成NA个O2 | |
| C. | 常温常压下,46 g NO2的原子数为3NA | |
| D. | 1 mol NO,与H2O完全反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
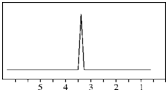 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)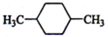 B、
B、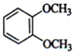 C、
C、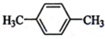 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
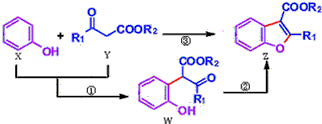
| A. | 反应①属于加成反应 | B. | W中含有三种不同的官能团 | ||
| C. | X、Y、W、Z都能与NaHCO3溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当4v(H2)=v(N2)时,反应达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})×{c}^{4}({H}_{2}O)}{c(S{O}_{2})×{c}^{2}(NO)×{c}^{4}({H}_{2})}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com