
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:

当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
【答案】-203.5 kJmol-1 0.36 37.5% 减小 温度升高时,-lg(![]() )减小,则
)减小,则![]() 增大,化学平衡向逆向移动,化学平衡常数减小 H+与Fe粉反应生成H2 Fe与置换出的Cu构成原电池,加快NO3-的去除速率 3.84×10-5 C D
增大,化学平衡向逆向移动,化学平衡常数减小 H+与Fe粉反应生成H2 Fe与置换出的Cu构成原电池,加快NO3-的去除速率 3.84×10-5 C D
【解析】
(1)根据目标反应方程式,①×2+2×②-③,△H=(-41.0×2-49.0×2-23.5)kJ·mol-1=-203.5kJ·mol-1;(2)①根据化学平衡常数的定义,K3=![]() ,K1=
,K1=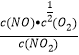 ,K2=
,K2=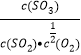 ,K3=K1×K2=0.018×20=0.36;②
,K3=K1×K2=0.018×20=0.36;②
SO2(g)+NO2(g)SO3(g)+NO(g)
起始: 0.2 0.2 0 0
变化: x x x x
平衡: 0.2-x 0.2-x x x 根据化学平衡常数的表达式,求出x=0.075mol,则SO2的转化率为0.075/0.2×100%=37.5%;③根据坐标系,温度升高时,-lg(PSO2)减小,则PSO2增大,化学平衡向逆向移动,化学平衡常数减小;(3)①pH偏低,c(H+)增大,Fe能与H+反应生成H2,造成与NO3-反应Fe的量减少,使NO3-的去除率降低;②II中加入少量的Cu2+,Fe能把Cu2+置换出来,构成原电池,加快反应速率,从而加快NO3-去除率;0~20min消耗NO3-的物质的量浓度为(8×10-4-0.32×10-4)mol·L-1=7.68×10-4mol·L-1,根据化学反应速率数学表达式,v(NO3-)=7.68×10-4/20mol/(L·min)=3.84×10-5mol/(L·min);(4)A、根据电荷守恒,因此有c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故A说法正确;B、根据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故B说法正确;C、HSO3-的水解平衡常数为Kh=Kw/Ka1=![]() ≈7×10-13<Ka1,HSO3-的电离程度大于水解程度,溶液显酸性,即离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故C说法错误;D、根据质子守恒,c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故D说法错误;综上所述CD符合题意。
≈7×10-13<Ka1,HSO3-的电离程度大于水解程度,溶液显酸性,即离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故C说法错误;D、根据质子守恒,c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故D说法错误;综上所述CD符合题意。


科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有 K+、Fe3+、Cl-、Mg2+、I-、CO32-、SO42-,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是

A.试剂①为硝酸钡
B.试剂②一定为盐酸
C.该溶液中一定有 I-、CO32-、SO42-、K+
D.通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.因为硫单质具有氧化性,故铁粉与硫粉共热可以生成Fe2S3
B.硫在空气中燃烧的产物是SO2,在纯氧中燃烧的产物是SO3
C.SO2的水溶液能导电,所以SO2是电解质
D.二氧化硫可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个F-最近的F-有6个
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com