
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
分析 ①氯水中存在Cl2+H2O?HCl+HClO,次氯酸易分解;
②氯气与水反应生成盐酸和HClO,HClO具有漂白性;
③二氧化硫能够与水反应生成亚硫酸,溶液显酸性,二氧化硫具有漂白性,但是不能漂白指示剂;
④依据二氧化硫具有漂白性解答;
⑤氨气为碱性气体,能够使酚酞变红.
解答 解:①氯水中存在Cl2+H2O?HCl+HClO,次氯酸易分解,使平衡向正方向移动,氯气浓度降低,颜色变浅,故正确;
②氯气与水反应生成盐酸和HClO,HClO具有漂白性,溶液具有酸性遇到石蕊变红,次氯酸具有漂白性,所以变红的溶液又褪色,故正确;
③二氧化硫能够与水反应生成亚硫酸,溶液显酸性,遇到石蕊变红,二氧化硫不能漂白指示剂,所以溶液不褪色,故错误;
④二氧化硫具有漂白性,能使品红褪色,故正确;
⑤氨气为碱性气体,能够使酚酞变红,故正确;
故选C.
点评 本题综合考查元素化合物知识,熟悉二氧化硫、氯气的性质是解题关键,注意二氧化硫不能漂白指示剂,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 12种 | C. | 15种 | D. | 20种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
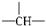 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
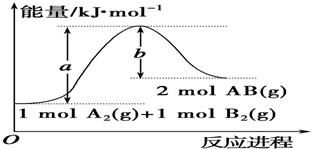
| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应吸收热量 (a-b)kJ | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1mol A-A和1mol B-B键,放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
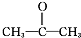 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ROH | B. | R2O7 | C. | HRO3 | D. | NaR |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
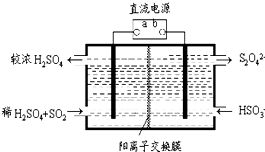 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的空间构形 |
| SO3 | 0 | sp2杂化 | 平面三角形 |
| PO43- | 0 | sp3杂化 | 正四面体 |
| NCl3 | 1 | sp3杂化 | 三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 g NH3所含氢原子数目为3NA | |
| B. | 1L 1mol/L的盐酸溶液中,含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com