
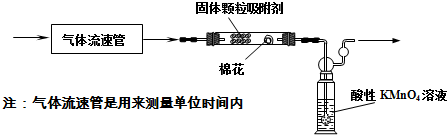
分析 设计实验方案:测定二氧化硫的存在,可利用二氧化硫具有漂白性和还原性的角度分析;
(1)①实验前应检查装置的气密性;
②KMnO4具有强氧化性,二氧化硫具有还原性,两者发生反应,KMnO4溶液褪色;
③测出二氧化硫的物质的量以及空气的体积即可求出空气中SO2含量;
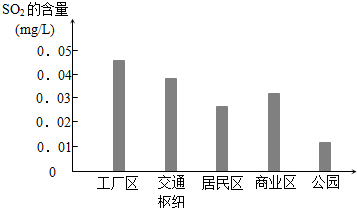
(2)①工厂尾气、汽车尾气中SO2含量较高;
②改用更洁净的能源减少SO2的排放.
解答 解:设计实验方案:测定二氧化硫的存在,可利用二氧化硫具有漂白性和还原性的性质,利用SO2使品红溶液褪色作定性分析,只要是利用了二氧化硫的漂白性,可品红溶液反应生成无色物质,
(1)①实验前应检查装置的气密性,以确保装置不漏气,以防止影响结果,故答案为:检查装置的气密性;
②KMnO4具有强氧化性,二氧化硫具有还原性,两者发生反应,所以看到KMnO4溶液刚好褪色时,说明二氧化硫和恰好KMnO4溶液完全反应,应停止通空气,二氧化硫的物质的量可以根据KMnO4的物质的量进行求出,而空气的体积需要知道单位时间内空气的流速和时间来计算,所以需要知道酸性KMnO4溶液刚好褪色所需要的时间,
故答案为:KMnO4溶液刚好褪色,通人空气至酸性KMnO4溶液刚好褪色所需要的时间;
(2)①因工厂尾气中含有大量的SO2、汽车尾气中SO2含量也较高,所以工厂区、交通枢纽SO2含量明显高于其他地区,
故答案为:工厂尾气、汽车尾气中SO2含量较高;
②SO2来源于化石燃料的燃烧,可通过环保能源来减少SO2的排放,或对燃煤进行脱硫处理,
故答案为:提高脱硫技术.
点评 本题综合考查了二氧化硫含量的测定以及二氧化硫的来源与危害,侧重于学生的分析能力的考查,题目涉及化学与生活、环境保护的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | C在O2充足时,发生的反应主要是放热反应 | |
| B. | 煤燃烧时吹入的氧气越多越好 | |
| C. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO这一反应属于吸热反应 | |
| D. | 煤燃烧时,反应物自身总能量高于生成物总能量,所以放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘水中加入适量酒精,可以将碘单质萃取出来 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发时,当溶液中出现大量晶体时,停止加热余热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O |
| B | 能与铝反应生成氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-═NH3•H2O |
| C | 常温下c(H+)/c(OH)-=10-10的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+═3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-═H2SiO3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
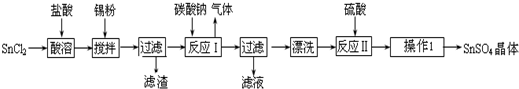
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com