
| A. | 6Li和7Li的电子数相等,中子数也相等 | |
| B. | 1H和2H是不同的核素,它们的质子数相等 | |
| C. | 14C和14N的质量数相等,它们的中子数不等 | |
| D. | 13C和14C属于同一元素,它们互为同位素 |
分析 在原子的构成中,元素符号左上角的数字表示原子的质量数;原子中,质量数=质子数+中子数,核内质子数=核外电子数=原子序数;
核素的种类由质子数和中子数决定;
元素的种类由质子数决定;
具有相同质子数、不同中子数的原子互为同位素.
解答 解:A.6Li和 7Li的质子数都为3,电子数也都为3,中子是分别为6-3=3、7-3=4,所以中子数不相等,故A错误;
B.1H和 2H的质子数都为1,中子数分别为0、1,所以1H和 2H是不同的核素,故B正确;
C.14C和 14N的质量数相等,质子数分别为6、7,中子数分别为14-6=8、14-7=7,所以它们的中子数不等,故C正确;
D.13C和 14C的质子数都为6,属于同一种元素,中子数分别为13-7=7、14-6=8,所以它们互为同位素,故D正确;
故选A.
点评 本题考查同位素及原子的构成,明确同位素的概念及原子中的量的关系是解答本题的关键,难度不大,注重了对基础知识的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
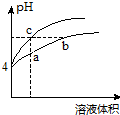 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )| A. | a、c两点溶液的导电能力:c>a | |
| B. | a、b、c三点溶液中水的电离程度:a>b>c | |
| C. | b点溶液中:c(H+)=c(Cl-)+c(OH-) | |
| D. | 用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁粉与氯气反应生成FeCl2 | |
| B. | 少量SO2通入Ca(ClO)2 溶液生成CaSO3沉淀 | |
| C. | 常温下,1 mol Fe与足量浓硝酸反应,转移2NA个电子 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
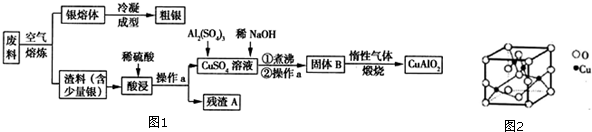
 .
. .写出③的转化关系
.写出③的转化关系 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (用已知中的表达式表示,不用写化学方程式)
(用已知中的表达式表示,不用写化学方程式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 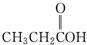 | B. | 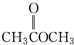 | C. | 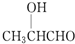 | D. | 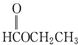 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=9.0mol/(L•min) | B. | v(B)=0.6 mol/(L•s) | C. | v(C)=0.3 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
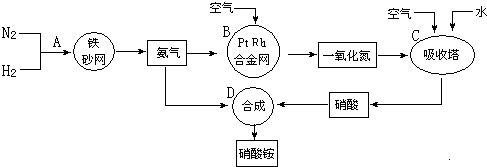
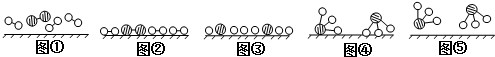
 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com