
【题目】下列图示中,A、B是金属单质,E、K是非金属单质,其它为化合物,F、G、H、I、J 焰色反应均为黄色,在这些物质中只有C、K是气体,其中K是黄绿色气体,反应⑧⑨是工业由H制I的重要反应。
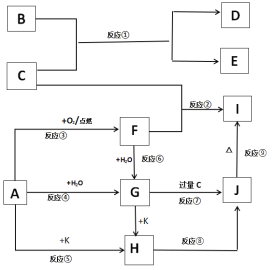
填写下列空白:
(1)写出化学式:B___,F___。
(2)写出反应①的化学反应方程式:____。
(3)写出反应⑦离子反应方程式:___。
【答案】Mg Na2O2 2Mg+CO2![]() 2MgO+C OH-+CO2=HCO3-
2MgO+C OH-+CO2=HCO3-
【解析】
由“K是黄绿色气体”,可确定K为Cl2;由“F、G、H、I、J 焰色反应均为黄色”,可确定A为Na,则F为Na2O2,G为NaOH,H为NaCl。由![]()
可确定J为NaHCO3,C为CO2,I为Na2CO3。
金属单质B能与CO2反应,则B为Mg,从而得出D为MgO,E为C。
(1)从上面分析中,我们可确定B、C的化学式。
(2)反应①是Mg与CO2发生的置换反应,产物为MgO和C。
(3)反应⑦为过量CO2与NaOH反应生成NaHCO3。
由“K是黄绿色气体”,可确定K为Cl2;由“F、G、H、I、J 焰色反应均为黄色”,可确定A为Na,则F为Na2O2,G为NaOH,H为NaCl。由![]()
可确定J为NaHCO3,C为CO2,I为Na2CO3。
金属单质B能与CO2反应,则B为Mg,从而得出D为MgO,E为C。
(1)从上面分析中,我们可确定化学式:B为Mg,F为Na2O2;答案为:Mg;Na2O2;
(2)反应①是Mg与CO2发生的置换反应,产物为MgO和C,反应方程式为2Mg+CO2![]() 2MgO+C;答案为:2Mg+CO2
2MgO+C;答案为:2Mg+CO2![]() 2MgO+C;
2MgO+C;
(3)反应⑦为过量CO2与NaOH反应生成NaHCO3,反应的离子方程式为
OH-+CO2=HCO3-。答案为:OH-+CO2=HCO3-。


科目:高中化学 来源: 题型:
【题目】液氨是富氢物质,是氢能的理想载体。下列说法不正确的是( )
A. NH3分子中氮原子的杂化方式为sp3杂化
B. [Cu(NH3)4]2+中,NH3分子是配体
C. NH![]() 与PH
与PH![]() 、CH4、BH
、CH4、BH![]() 互为等电子体
互为等电子体
D. 相同压强下,NH3的沸点比PH3的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着老百姓生活水平的提高,汽车进入寻常百姓家,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
A.氧化剂与还原剂的物质的量之比为5:1B.N2既是氧化产物也是还原产物
C.NaN3是氧化剂D.KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A 铁 B 铝 C 铂 D 玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
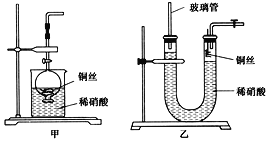
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置,
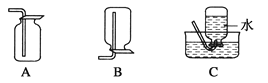
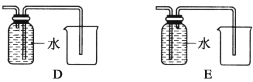
合理的是________(填选项代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。___
(2)若通入CO2气体为2.24L(标准状况下),得到9.5g的白色固体。
①请通过计算确定此白色固体组成为___。
②所用的NaOH溶液的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有原子的物质的量为________mol,所含电子的物质的量为________mol。
(3)1.204×1023个![]() 的物质的量为________mol,质量为________g。
的物质的量为________mol,质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有___________(填化学式);写出反应I中含铍化合物与过量盐酸反应的离子方程式:___________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是___________;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是___________。
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为___________。
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是________(填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com