
分析 分别物质的量都为a mol的铝和镁两种金属,分别发生2Al+6HCl=2AlCl3+3H2↑,Mg+2HCl=MgCl2+H2↑,根据差量法计算分析哪一盘的烧杯轻,再根据轻多少分析加入多少克砝码,以此解答.
解答 解:根据题意,分别物质的量都为a mol的铝和镁两种金属,分别发生
2Al+6HCl=2AlCl3+3H2↑,增重
2 2×27-3×2=48
a 24a
Mg+2HCl=MgCl2+H2↑,增重
1 24-2=22
a 22a
则右盘的烧杯加镁,增重小,所以右盘的烧杯轻,应在右盘加入24a-22a=2a克砝码才能平衡,
答:右盘的烧杯轻,应在右盘加入2a克砝码才能平衡.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,注意把握反应的关系式或方程式,根据差量法计算为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g | B. | 48g | C. | 16g | D. | 64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O4属于离子化合物 | B. | X的离子符号为N2O+ | ||
| C. | Y的离子符号为NO2- | D. | 铜与液体N2O4反应会生成NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{10}{23}$mol | B. | 1mol | C. | $\frac{1}{46}$mol | D. | $\frac{1}{25}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L pH=3的H2A溶液与0.01mol pH=11的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A2-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | $\stackrel{23}{11}$Na | ||
| C. | 1s22s22p63s1 | D. | 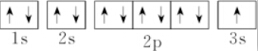 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com